HOME м•ҢлҰјмҶҢмӢқ кё°мҲ лҸҷн–Ҙ
| [BRIC] SMC ліөн•©мІҙ: DNAм—җм„ң м—јмғүмІҙк№Ңм§Җ |
| мқҙлҰ„ : н‘ңмӨҖм„ұкіјн•ҷмӮ°нҢҖ | мһ‘м„ұмқј : 2017.11.07 | мЎ°нҡҢмҲҳ : 30170 |
| кё°кҙҖ : мғқл¬јн•ҷм—°кө¬м •ліҙм„јн„°(BRIC) |
|
SMC ліөн•©мІҙ: DNAм—җм„ң м—јмғүмІҙк№Ңм§Җ
лҘҳм ңкІҪ / лҚён”„нҠё кіөлҢҖ
[лӘ© м°Ё]
1. м„ңлЎ
[мҡ”м•Ҫл¬ё]
SMC (Structural maintenance of chromosomes, м—јмғүмІҙ кө¬мЎ° мң м§Җ) ліөн•©мІҙлҠ” condensin, cohesinкіј SMC5-SMC6 ліөн•©мІҙлҘј нҸ¬н•Ён•ҳлҠ”лҚ° мқҙкІғл“ӨмқҖ л°•н…ҢлҰ¬м•„м—җм„ңл¶Җн„° мӮ¬лһҢм—җ мқҙлҘҙкё°к№Ңм§Җ лӘЁл“ мӮҙм•„мһҲлҠ” мғқлӘ…мІҙмқҳ м—јмғүмІҙлҘј кө¬м„ұн•ҳлҠ” мЈјмҡ” мҡ”мҶҢл“ӨмқҙлӢӨ. ATP к°ҖмҲҳ분н•ҙлҘј нҶөн•ҙм„ң лҸҷл Ҙмӣҗмқ„ м–»лҠ” мқҙлҹ¬н•ң л§Ғ кө¬мЎ°мқҳ лӢЁл°ұм§Ҳ кё°кі„л“ӨмқҖ мң„мғҒм ҒмңјлЎң DNAлҘј к°җмӢјлӢӨ. н•ң к°ң мқҙмғҒмқҳ DNA к°ҖлӢҘмқ„ к°Җм§Җкі мһҲлҠ” мқҙ лӢЁл°ұм§Ҳл“Өмқҳ лҠҘл ҘмқҖ м§ҖлӮҳм№ң м—јмғүмІҙмқҳ нҷңм„ұмқ„ мЎ°м Ҳн•ңлӢӨ. мқҙл“Ө мӨ‘ мӨ‘мҡ”н•ң кІғмқҖ м—јмғүмІҙ мқ‘집과 мһҗл§Өм—јмғү분мІҙ(sister chromatid cohesion)л“Өмқҳ кІ°н•©мқҙлӢӨ. кІҢлӢӨк°Җ, SMC ліөн•©мІҙл“ӨмқҖ DNA ліөкө¬(DNA repair)м—җлҸ„ мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ңлӢӨ. мқҙл“Ө ліҙнҺём Ғмқё м—јмғүмІҙ кё°кі„л“Өмқҳ кё°лҠҘкіј мЎ°м Ҳм—җ лҢҖн•ң лҢҖн•ң мөңк·ј кё°мһ‘ нҶөм°°л ҘмқҖ м—јмғүмІҙмқҳ кө¬мЎ°, лҸҷм—ӯн•ҷкіј кё°лҠҘмқ„ м ңм•Ҳн•ҳкІҢ л§Ңл“ҰмңјлЎң мғқл¬јн•ҷмқҳ кё°ліём Ғмқё мӢӨмІҙл“Ө мӨ‘ н•ҳлӮҳлҘј мЎ°лӘ…н•ҳкІҢ н–ҲлӢӨ.
1. м„ңлЎ
мӮ¬лһҢм—җм„ңлҠ” 4 meterмқҳ DNAк°Җ micrometer мҠӨмјҖмқјмқҳ м„ёнҸ¬ н•өм—җ мқ‘축мқҙ лҗңлӢӨ. м–ҙл–»кІҢ DNAк°Җ мқҙл ҮкІҢ мһ‘мқҖ мҠӨмјҖмқјмқҳ кө¬мЎ°лЎң л§Ңл“Өм–ҙм§ҖлҠ”м§ҖлҠ” мғқлӘ… нҳ„мғҒмқҳ мғҒ징м Ғмқё мҡ”мҶҢмқё м—јмғүмІҙлҘј мқҙн•ҙн•ҳлҠ”лҚ° лҸ„мӣҖмқҙ лҗңлӢӨ. м—јмғүмІҙлҠ” DNAлЎңл§Ң мқҙлӨ„진 кІғмқҙ м•„лӢҲлқј, м—јмғүмІҙлҘј л§Ңл“Өм–ҙлӮҙлҠ” лӢӨм–‘н•ң лӢЁл°ұм§Ҳл“Өлҝҗл§Ң м•„лӢҲлқј мң м „мһҗ л°ңнҳ„кіј кІҢлҶҲ мң м§ҖлқјлҠ” кё°лҠҘмқ„ н•ҳкІҢ н•ңлӢӨ. мқҙлҹ° мҡ”мҶҢл“Ө мӨ‘ к°ҖмһҘ мӨ‘мҡ”н•ң кё°лҠҘмқ„ н•ҳлҠ” кІғмқҙ SMC ліөн•©мІҙл“ӨмқҙлӢӨ. м—јмғүмІҙ мқ‘축, мһҗл§Өм—јмғү분мІҙмқҳ кІ°н•©, к·ёлҰ¬кі DNA ліҙмҲҳ(repair)м—җ лҢҖн•ҙ мҙҲм җмқ„ л‘ҳ кІғмқҙлӢӨ. мқҙ лҰ¬л·°м—җм„ңлҠ” м–ҙл–»кІҢ eukaryotic SMC ліөн•©мІҙл“Өмқҙ chromosomeм—җ м—ӯн• мқ„ н•ҳлҠ”м§Җм—җ лҢҖн•ң мөңмӢ мқҙн•ҙлҘј 분м„қн• кІғмқҙкі , кё°мһ‘мқ„ мқҙн•ҙн•ҳлҠ” мөңмӢ 진ліҙлҗң м—°кө¬лҘј мҶҢк°ңн•ҳкі мһҗ н•ңлӢӨ. Chromosome мқ‘축, мһҗл§Ө chromatid кІ°н•©м—җ лҢҖн•ҙ мҙҲм җмқ„ л‘җл©ҙм„ң DNA repairм—җ лҢҖн•ҙм„ңлҸ„ мўҖ лӢӨлЈЁкі мһҗ н•ңлӢӨ.
мһҗл§Ө м—јмғү분мІҙ кІ°н•©(Sister chromatid cohesion): S phaseм—җм„ң DNA ліөм ңлҗҳлҠ”лҚ° мқҙ л•Ң мғқкёҙ DNA л‘җ м§қмқҙ м„ңлЎң м—°кІ°лҗҳм–ҙ мһҲлҠ” кіјм •мқ„ л§җн•ңлӢӨ. мһҗл§Өм—јмғү분мІҙ кІ°н•©мқҖ G2мҷҖ mitosisк№Ңм§Җ м§ҖмҶҚлҗңлӢӨ. мқҙкІғмқҙ м§қмңјлЎң мқём§Җлҗҳкі , mitotic spindle apparatusм—җ мқҳн•ҙ м •л ¬мқҙ лҗңлӢӨ.
лҸҷмӣҗмІҙ(Centromere): м—јмғүмІҙмҷҖ microtubule мқҙ м—°кІ° лҗҳлҠ” м—јмғүмІҙмқҳ мһҗлҰ¬мқҙлӢӨ. лҸҷмӣҗмІҙлҠ” нҠ№лі„н•ң kinetochore (Microtubuleкіј лҸҷмӣҗмІҙлҘј м—°кІ°н•ҳлҠ” нҒ° лӢЁл°ұм§Ҳ мЎ°лҰҪмІҙ) мң„м—җ мһҲлҠ” chromatinмңјлЎң кө¬м„ұлҗҳм–ҙ мһҲлӢӨ.
Bi-orientation: л‘җ к°ңмқҳ мһҗл§Ө лҸҷмӣҗмІҙл“Өмқҙ microtubule мқҙ м—°кІ°лҗҳм–ҙ мһҲлҠ” мғҒнғңм—җм„ң м„ңлЎң лӢӨлҘё л°©н–ҘмңјлЎң ліҙкі мһҲлҠ” мғҒнғңлҘј мқҳлҜён•ңлӢӨ. мқҙкІғмқҖ spindleм—җм„ң лӮҳмҳЁ microtubuleм—җ л¶Җм°©лҗҳм–ҙ мһҲлӢӨ.
Inner kinetochore: DNAмҷҖ м ‘мҙүн•ҳлҠ” kinetochore л¶Җмң„мқёлҚ°, мқҙкІғмқҖ microtubuleм—җ м—°кІ°лҗҳм–ҙ мһҲлҠ” outer ki-netochoreкіј л°ҳлҢҖмқҙлӢӨ.
Topoisomerase II: DNAмқҳ л‘җ strandлҘј мқјмӢңм ҒмңјлЎң лҸҷмӢңм—җ мһҗлҘҙлҠ” нҡЁмҶҢмқҙкі мқҙкІғмқҖ лӢӨлҘё DNAк°Җ м§ҖлӮҳк°Җл Өкі н• л•Ң л‘җ к°ӯмқҙ лӢӨмӢң н•©міҗм§Җкё° м „м—җ мқјм–ҙлӮңлӢӨ.
Replication forks: DNA double helixк°Җ н’ҖлҰ¬лҠ” м§Җм җ, м—¬кё°м—җ мғҲ DNAк°Җ н•©м„ұмқҙ лҗҳл©ҙм„ң chromosomeмқ„ ліөм ңн•ңлӢӨ.
25л…„ м „м—җ Niki, HiragaмҷҖ к·ёл“Өмқҳ лҸҷлЈҢл“ӨмқҖ chromosome segregationм—җ мһ‘мҡ©н•ҳлҠ” лӢЁл°ұм§Ҳ кө°мқ„ мғҲлЎӯкІҢ л°ңкІ¬н–ҲлӢӨ. мқҙкІғл“Өмқҳ лҸҢм—°ліҖмқҙлҠ” E. coli м—җм„ң л¬ҙн•ө мһҗмҶҗмқ„ мһҗмЈј л§Ңл“Өм–ҙлӮҙлҠ” кІғмқҙм—Ҳкі , мқҙкІғмқҙ мөңмҙҲлЎң gene encodingлҗҳм–ҙ SMC лӢЁл°ұм§ҲлЎң м•Ңл Ө진 MukBмқҙлӢӨ. м—јкё° м„ңм—ҙлЎң N-л§җлӢЁ, C-л§җлӢЁ кө¬нҳ•мғҒмқҳ ATPase кө¬м—ӯмңјлЎң мҳҲмёЎмқҙ лҗҳм—Ҳкі , мқҙкІғмқҖ кёёкІҢ лҠҳм–ҙ진 coiled-coilлЎң 분лҰ¬лҗҳм—ҲлӢӨкі мҳҲмёЎмқҙ лҗҳм—ҲлҠ”лҚ° мқҙкІғмқҖ MukB лӢЁл°ұм§Ҳмқҳ м „мһҗнҳ„лҜёкІҪ мқҙлҜём§ҖлЎң мҰқлӘ…мқҙ лҗҳм—ҲлӢӨ. к·ё мқҙнӣ„м—җлҠ” budding yeastм—җм„ң вҖҳstability of minichromosomesвҖҷ мқҙлқјлҠ” SMC1 geneмқҙ нҒҙлЎңлӢқмқҙ лҗҳм—Ҳкі , мқҙкІғмңјлЎң Smc1 лӢЁл°ұм§Ҳмқҙ л°ңкІ¬лҗҳм—ҲлӢӨ. к·ёлҰ¬кі лӢӨм–‘н•ң мғқлӘ…мІҙм—җм„ң 비мҠ·н•ң лӢЁл°ұм§Ҳл“Өмқҙ л°ңкІ¬лҗҳм—ҲлӢӨ. Fission yeastм—җм„ңлҠ” cut3+мҷҖ cut14+к°Җ л°ңкІ¬мқҙ лҗҳм—ҲлҠ”лҚ°, мқҙл“Өмқҳ mutation(лҸҢм—°ліҖмқҙ)л“ӨмқҖ м—јмғүмІҙ мқ‘축과 분м—ҙкіјм •мқҳ кІ°н•Ёмқ„ к°Җм§Җкі мһҲлӢӨ.
비мҠ·н•ң мӢңкё° Xenopus chromosomeм—җ кІ°н•©лҗң лӢЁл°ұм§Ҳмқё XCAPC(Smc2лЎң м—¬кІЁм§җ)мҷҖ XCAPE(Smc4лЎң м•Ңл Өм§җ)мқҙ л°ңкІ¬лҗҳм—ҲлӢӨ. к·ёлҰ¬кі , мқҙ лӢЁл°ұм§Ҳл“ӨмқҖ egg extract assayлҘј нҶөн•ҙ chromosome condensation м—ӯн• м—җ н•„мҡ”н•ҳлӢӨлҠ” кІғмқ„ м•ҢкІҢ лҗҳм—ҲлӢӨ. 135 kDAмқҳ chicken cell м—јмғүмІҙмқҳ мӨ‘мҡ”н•ң кө¬м„ұмҡ”мҶҢмқё м—јмғүмІҙ scaffold лӢЁл°ұм§Ҳ ScII(SMC2лЎң м•Ңл Өм§җ)мқҖ XCAPEмқҳ мғҒлҸҷмң м „мһҗмһ„мқҙ л°қнҳҖмЎҢлӢӨ. кІҢлӢӨк°Җ budding yeast geneмқҙл©ҙм„ң, XCAPEмқҳ orthologueмқё smc2 мң м „мһҗмқҳ лҸҢм—°ліҖмқҙлҠ” м—јмғүмІҙм—җ мқ‘축мқҳ defectлҘј мқјмңјмј°лӢӨ. мқҙкІғмқҖ SMCмңјлЎң м—јмғүмІҙ кө¬мЎ° мң м§Җ(Structural Maintenance of Chromosomes)лқјкі л¶ҖлҘҙкІҢ лҗҳм—ҲлӢӨ.
мҙҲкё°м—җлҠ” м—јмғүмІҙ кө¬мЎ°м—җм„ң SMC лӢЁл°ұм§Ҳл“Өмқҙ м—јмғүмІҙ лӘЁм–‘лӮҙлҠ” кІғкіј segregationмқ„ л„ҳм–ҙм„ңлҠ” м–‘мғҒмқ„ к°Җм§Ҳ кІғмқҙлқјкі ліҙм•ҳлӢӨ. Caenorhabditis elegansм—җм„ңмқҳ м„ұм—јмғүмІҙм—җм„ң dosage compensation м—°кө¬лҠ” SMC лӢЁл°ұм§Ҳмқҳ gene encondingм—җм„ң вҖҳdumpyвҖҷ dpy-27 лҸҢм—°ліҖмқҙлҘј л°ңкІ¬н•ҳкІҢ н–ҲлӢӨ. мқҙкІғмқҖ hermaphorodite XX нғңм•„м—җм„ңмқҳ X м—јмғүмІҙм—җм„ңл¶Җн„°мқҳ gene expressionмқ„ downregulateн•ҳлҠ” кІғмқ„ м Җн•ҙн•ҳмҳҖлӢӨ. кІҢлӢӨк°Җ, fission yeastм—җм„ң radiation sensitive лҸҢм—°ліҖмқҙлЎң м•Ңл Ө진 rad 18мқҖ Smc5мҷҖ Smc6лЎң м•Ңл Ө진 SMC лӢЁл°ұм§Ҳ м„ңлёҢ к·ёлЈ№л“Өмқҙ л°ңкІ¬лҗҳм—ҲлӢӨ.
лҳҗ лӢӨлҘё SMC лӢЁл°ұм§Ҳмқ„ мқҙн•ҙн•ҳлҠ” мӨ‘мҡ”н•ң мҠӨн…қмқҖ мқҙ лӢЁл°ұм§Ҳмқҙ мӨ‘мҡ”н•ң 3к°ңмқҳ multi-subunit лӢЁл°ұм§Ҳ ліөн•©мІҙлҘј eukaryotesм—җм„ң нҳ•м„ұн•ңлӢӨлҠ” кІғмқҙлӢӨ. XCAPCмҷҖ XCAPE(Smc4мҷҖ Smc2лЎң м•Ңл Ө진) м„ңлёҢмң лӢӣл“ӨмқҖ 5к°ңмқҳ subunitмңјлЎң мқҙлЈЁм–ҙ진 condensin ліөн•©мІҙмқҳ л¶ҖмҶҚн’Ҳл“ӨмқҙлӢӨ. 비мҠ·н•ҳкІҢ мһҗл§Ө chromatid cohesionмқ„ л§Өк°ңн•ҳлҠ” лӢЁл°ұм§Ҳмқ„ м°ҫлҠ” м—°кө¬лҠ” cohesin ліөн•©мІҙлҘј л°ңкІ¬н•ҳкІҢ н–ҲлӢӨ. мқҙкІғмқҖ Smc1мҷҖ Smc3 м„ңлёҢмң лӢӣл“ӨмқҙлӢӨ. Smc5мҷҖ Smc6 м„ңлёҢмң лӢӣл“ӨмқҖ multi-subunit DNA repair complexмқҳ кё°л°ҳмқ„ л§Ҳл Ён•ңлӢӨ. мқҙ м„ёк°Җм§Җ лӢЁл°ұм§Ҳл“Өмқҙ eukaryotic lifeм—җ мӨ‘мҡ”н•ҳм§Җл§Ң мқҙл“ӨмқҖ м•Ҫк°„мқҳ overlappingлҗҳлҠ” м—ӯн• мқҙ мһҲлӢӨ. мҳҲлҘј л“Өм–ҙ cohesinмқҖ chromosome condensationм—җ кҙҖм—¬н•ҳм§Җл§Ң, cohesinкіј condensinмқҖ DNA repairм—җ м—ӯн• мқ„ н•ңлӢӨ.
Cohesin ліөн•©мІҙл“Өмқҙ мһҗл§Ө chromatid кІ°н•©м—җ кҙҖм—¬н•ңлӢӨлҠ” л°ңкІ¬мқҖ SMC ліөн•©мІҙл“Өмқҙ eukaryotic м—јмғүмІҙ segregationм—җ мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ңлӢӨлҠ” кІғмқ„ ліҙм—¬мӨ¬лӢӨ. мһҗл§Ө chromatidл“ӨмқҖ S phaseм—җм„ң DNA ліөм ң кё°к°„ лҸҷм•Ҳм—җ мғқм„ұмқҙ лҗңлӢӨ. к·ёлҰ¬кі mitosisк№Ңм§Җ 묶여 мһҲлҠ” мғҒнғңк°Җ лҗңлӢӨ. мқҙкІғмқҖ мһҗл§Ө chromatid л“Өмқҙ pairwiseлЎң л¶ҷкІҢ н•ҳкі , micotic spindleм—җ мқҳн•ҙм„ң tensionмқ„ л°ӣкІҢ лҗҳм–ҙм„ң м •л ¬мқ„ н•ҳкІҢ лҗңлӢӨ. мқҙ cohesinмқҳ Scc1 (sister chromatid cohesion 1) м„ңлёҢмң лӢӣмқҖ лӢЁл°ұм§Ҳм—җ мқҳн•ҙм„ң мһҳлҰ¬кІҢ лҗҳкі , мқҙкІғмқҙ cohesinмқ„ м—јмғүмІҙм—җм„ң 분лҰ¬мӢңмјң anaphasлЎң л§Ңл“ лӢӨ. мқҙкІғмқҖ лӢӨлҘё л¶ҖмҲҳм Ғмқё м—ӯн• л“Өкіј н•Ёк»ҳ cell cycleм—җм„ң SMC лӢЁл°ұм§Ҳл“Өмқҙ мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ҳкІҢ л§Ңл“ лӢӨ.
3. SMC ліөн•©мІҙл“Өмқҳ architecture
SMC ліөн•©мІҙл“ӨмқҖ ring нҳ•нғңмқҳ кө¬мЎ°лЎң лҗҳм–ҙ мһҲлӢӨ(к·ёлҰј 1a). мқҙ л§Ғ кө¬мЎ°лҠ” л‘җ к°ңмқҳ SMC subunitsмқҳ кёёкІҢ л»—м–ҙ진 coiled-coilлЎң мқҙлЈЁм–ҙм ё мһҲкі , мқҙ coiled-coilмқҖ coiled-coil л¶Ҳм—°мҶҚм„ұ л•Ңл¬ём—җ м•„мЈј мң м—°н•ҳлӢӨ. мқҙ coiled-coil л¶Җ분мқҖ н•ң мӘҪ лҒқм—җ м•Ҳм •м ҒмңјлЎң dimerizationлҗң hingeлЎң м•Ңл Ө진 interfaceлЎң м—°кІ°лҗҳм–ҙ мһҲлӢӨ. лӢӨлҘё мӘҪ лҒқмқҖ ATP-binding cassette (ABC) family ATPase лҸ„л©”мқёмңјлЎң лҗҳм–ҙ мһҲлӢӨ. мқҙ кІғмқҳ dimerizationмқҖ ATPк°Җ мһҲмқ„ л•Ң мқҙлӨ„м§Җкі , л‘җ к°ңмқҳ head мӮ¬мқҙм—җм„ң мғҢл“ңмң„м№ҳлЎң лҗңлӢӨ. мқҙ н—Өл“ңл“ӨмқҖ Kleisin subunitкіј ATPм—җ мқҳн•ҙ dimerк°Җ лҗңлӢӨ. SMC dimerлҠ” лҢҖмІҙлЎң лҢҖм№ӯм Ғмқё л°ҳл©ҙ, kleisinмқҖ SMC н—Өл“ңмҷҖ 비лҢҖм№ӯм Ғмқё м ‘мҙүмқ„ л§Ңл“ лӢӨ. Kleisinмқҳ N л§җлӢЁ л¶Җ분мқҖ SMC head лҸ„л©”мқём—җ к·јм ‘н•ң coiled coil нҳ•нғңмқҳ лӮҳм„ нҳ• лӢӨл°ңмқ„ нҳ•м„ұн•ңлӢӨ. Kleisinмқҳ C л°ңлӢЁмқҖ л°ҳлҢҖ н—Өл“ңмқҳ л°”лӢҘ л¶Җ분м—җ л¶ҷм–ҙ мһҲкІҢ лҗңлӢӨ(к·ёлҰј 1b). Оұ-suprahelical Heat repeatмқҖ kleisin к·јмІҳм—җ мЎ°лҰҪлҗңлӢӨ.
Ring кө¬мЎ°лҘј к°–лҠ” cohesin ліөн•©мІҙлҠ” DNAлҘј мң„мғҒм ҒмңјлЎң к°җмӢёл©ҙм„ң DNAм—җ кІ°н•©н•ңлӢӨ. м—¬кё°м„ң мң„мғҒм ҒмңјлЎң к°җмӢјлӢӨлҠ” кІғмқҖ cohesin ringмқҙ м—ҙлҰ¬кі DNAлҘј cohesin ring м•Ҳм—җ л„Јкі , cohesin ringмқҙ лӢ«нһҳмңјлЎң cohesin ring м•Ҳм—җ DNA к°ҖлӢҘмқҙ л“Өм–ҙк°ҖкІҢ н•ңлӢӨлҠ” кІғмқ„ л§җн•ңлӢӨ. мқҙ лӘЁлҚёмқҖ SMC ліөн•©мІҙмқҳ кё°лҠҘмқ„ м—°кө¬н•ҳлҠ”лҚ° мЈјмҡ” мӣҗлҰ¬к°Җ лҗҳм—ҲлӢӨ. In vivoм—җм„ңлҠ” cohesinмқҙ minichromosomeмқ„ мң„мғҒм ҒмңјлЎң к°җмӢјлӢӨлҠ” кІғкіј in vitroм—җм„ң ATP к°ҖмҲҳ분н•ҙ мқҳмЎҙлҗң DNAм—җ loadingмқҙ мң„мғҒм ҒмқҙлқјлҠ” кІғм—җ лҢҖн•ң к°•л Ҙн•ң мҰқкұ°к°Җ мһҲлӢӨ. мқҙмҷҖ 비мҠ·н•ҳкІҢ in vivoм—җм„ң condensinкіј Smc5-Smc6 ліөн•©мІҙлҸ„ мң„мғҒм ҒмңјлЎң minichromosomeкіј м—°кІ°лҗҳм–ҙ мһҲлӢӨ. л°ҳл©ҙ л°•н…ҢлҰ¬м•„ SMC ліөн•©мІҙл“ӨмқҖ мӣҗнҳ• нҳ•нғңмқҳ л°•н…ҢлҰ¬м•„ м—јмғүмІҙлҘј мң„мғҒм ҒмңјлЎң к°җмӢјлӢӨ. мқҙлҹ° мң„мғҒм Ғмқё entrapmentлҠ” SMC ліөн•©мІҙ кё°лҠҘмқҳ кІ°м •м Ғмқҙлқјкі к°„мЈјлҗңлӢӨ. мқҙ мҳЁм „н•ң cohesinмқҳ л§Ғ кө¬мЎ°лҠ” мһҗл§Өм—јмғү분мІҙмқҳ кІ°н•©м—җ н•„мҡ”н•ҳлӮҳ anaphaseм—җм„ңмқҳ Scc1мқҳ 분м—ҙмқҖ к·ё л§Ғмқ„ м—ҙкІҢ н•ңлӢӨ. 비мҠ·н•ҳкІҢ budding yeastм—җм„ң м—јмғүмІҙ 분м—ҙмӢң н•„мҲҳм Ғмқё кё°лҠҘмқ„ мң„н•ҙ мң„мғҒм ҒмңјлЎң мҶҗмғҒлҗҳм§Җ м•ҠмқҖ condensinмқҙ н•„мҡ”н•ҳлӢӨ. мң„мғҒм Ғмқё DNAм—җ кІ°н•©н•ҳлҠ” кІғмқҖ м–ҙл–»кІҢ SMC ліөн•©мІҙк°Җ м—јмғүмІҙм—җ мһ‘лҸҷн•ҳлҠ”м§Җм—җ лҢҖн•ң нӣҢлҘӯн•ң м„ӨлӘ… к°ҖлҠҘм„ұмқ„ м ңкіөн•ңлӢӨ. мқҙкІғмқҖ мң„мғҒм ҒмңјлЎң к°җмӢёлҠ” нҳ„мғҒ мҷёмқҳ лӢӨлҘё к°ҖлҠҘм„ұмңјлЎң мһ‘лҸҷлҗҳлҠ” кІғмқ„ л°°мІҷн•ҳм§ҖлҠ” м•ҠлҠ”лӢӨ.

к·ёлҰј 1. SMC лӢЁл°ұм§Ҳ ліөн•©мІҙ. a. ATP к°Җ л¶ҷм–ҙ мһҲлҠ” cohesin мӮ¬н•©мІҙ лӘЁлҚё. мқҙкІғмқҖ Protein Dat Bank (PDB) IDs 1GXL, 1W1W, 4PK7, кіј 4UX3 лЎң л§Ңл“Өм–ҙмЎҢлӢӨ. b. 진н•өмғқл¬јмқҳ SMC ліөн•©мІҙмҷҖ мқҙкІғмқҳ м„ңлёҢмң лӢӣл“Өмқҳ лҸ„н‘ң. мқҙ мқҙлҰ„л“ӨмқҖ budding yeast м—җм„ң мқҙмҡ©лҗҳлҠ” кІғмқҙлӢӨ. fission yeast мҷҖ мІҷ추лҸҷл¬јмқҳ мқҙлҰ„л“ӨмқҖ кҙ„нҳё н‘ңм—җ мһҲлӢӨ. Brn1, Barren homologue 1; Mms21, metyl methanesulfonate sensitivity; Nse, non-SMC element; Wapl, Wings apart-like protein homologue; Ycg1, yeast cap G 1; Ycs4, yeast condensing subunit 4. *Smc1 мқҖ kleisin C л§җлӢЁ л¶Җ분과 мғҒнҳёмһ‘мҡ©н•ҳкі Smc3 лҠ” kleisin мқҳ N л§җлӢЁ л¶Җ분과 мғҒнҳёмһ‘мҡ©н•ңлӢӨ. вҖЎcondensin II ліөн•©мІҙмқҳ лӢӨлҘё subunit мқ„ лӮҳнғҖлӮёлӢӨ. В§SA1 лҳҗлҠ” SA2 мҷҖ PDS5A лҳҗлҠ” PDS5B лҠ” лӢӨм–‘н•ң cohesin лҸҷнҳ•лӢЁл°ұм§Ҳм—җм„ң л°ңкІ¬лҗңлӢӨ. вҲҘSororin мқҖ нӣ„мғқлҸҷл¬ј cohesin м—җм„ң л°ңкІ¬мқҙ лҗңлӢӨ. Reprinted with permission from Nature publishing group images in a and b.
SMC ліөн•©мІҙл“ӨмқҖ м—јмғүмІҙл“Өкіј кІ°н•©кіј 분м—ҙмқ„ л°ҳліөн•ҳл©ҙм„ң мң лҸҷм Ғмқё кІ°н•©мқ„ н•ңлӢӨ. мқҙкІғм—җ лҢҖн•ң мҳҲмҷё мӮ¬н•ӯмқҖ cohesin 분мһҗл“Өмқҙ DNA ліөм ңн• л•Ң л‘җ к°ңмқҳ мһҗл§Өм—јмғү분мІҙлҘј мһЎлҠ” кІғмқҙлӢӨ. мқҙкІғмқҖ м§ҖмҶҚм ҒмңјлЎң DNAлҘј м•Ҳм •нҷ” мӢңнӮЁлӢӨ. мқҙ л‘җ к°Җм§Җ кІҪмҡ°м—җм„ң, л§Ңм•Ҫ SMC ліөн•©мІҙк°Җ мң„мғҒм ҒмңјлЎң DNAм—җ кІ°н•©мқ„ н•ңлӢӨл©ҙ DNAлҠ” м–ҙл–»кІҢ мқҙ ringм—җ л“Өм–ҙк°Җкі лӢӨмӢң лӮҳмҳӨкІҢ лҗ к№Ң? cohesin subunitмқҳ к°ңлі„м Ғмқё м ‘м җл“Өмқ„ лҙүмқён•ҳлҠ” лӢЁл°ұм§Ҳ engineeringмқҖ м„ёнҸ¬ м•Ҳм—җм„ң cohesin ringм—җм„ң DNAк°Җ л“Өм–ҙк°Җкі лӮҳк°ҖлҠ” pathлҘј м•Ңкё° мң„н•ҙм„ң мӮ¬мҡ©лҗҳм—ҲлӢӨ. Smc1 лҳҗлҠ” Smc3м—җ kleisinмқҳ н•ңмӘҪ лҒқмқ„ кіөмң кІ°н•©мңјлЎң м—°кІ°мӢңнӮӨкұ°лӮҳ н•ңмӘҪ лҒқмқ„ нҷ”н•ҷм ҒмңјлЎң мң лҸ„н• мҲҳ мһҲлҠ” dimerization interfaceлҘј лӢӨлҘё лҒқмӘҪмңјлЎң л¶ҷмқҙл©ҙ, м—јмғүмІҙм—җ cohesin loadingмқ„ л§үмқ„ мҲҳк°Җ м—Ҷм—ҲлӢӨ. к·ёмҷҖлҠ” л°ҳлҢҖлЎң нҷ”н•ҷм Ғмқё crosslinkingмқ„ SMC hinge м—җ мӮҪмһ…н•ҳл©ҙ cohesin loadingмқ„ л§үкІҢ лҗҳм—ҲлӢӨ. мқҙкІғмқҖ DNAлҠ” cohesin л§Ғм—җ hingeлҘј нҶөн•ҙм„ң л“Өм–ҙк°Җм•јл§Ң н•ңлӢӨлҠ” кІғмқ„ мқҳлҜён•ңлӢӨ. м°ЁлЎҖлЎң Smc3-kleisin м ‘мҙү л¶Җмң„лҘј мһ к·ёл©ҙ, cohesinмқҙ м—јмғүмІҙмң„м—җм„ң cohesinмқ„ м•Ҳм •нҷ” мӢңнӮЁлӢӨ. к·ёлһҳм„ң мқҙ м ‘мҙү л¶Җмң„лҘј DNA exit gateмқҳ нӣ„ліҙк°Җ лҗҳм—ҲлӢӨ. мқҙлҹ° мӢӨн—ҳл“Өмқҳ лӢЁм җмқҖ crosslinkкіј domain мӮҪмһ…мқҖ cohesinмқҳ кё°лҠҘмқ„ л¶ҖмҲҳм Ғмқё м ‘мҙүл©ҙмқ„ лӢ«кІҢ н•ҳкі , лҰ¬к°„л“ңк°Җ мң лҸ„н•ҳлҠ” dimerizationмқҙ 분н•ҙлҘј мғҒлҢҖм ҒмңјлЎң л№ лҘё 분н•ҙ мҶҚлҸ„лЎң н—Ҳмҡ©н• мҲҳ мһҲлӢӨлҠ” кІғмқҙлӢӨ.
Fission yeast cohesin ліөн•©мІҙлҘј мқҙмҡ©н•ҳм—¬ cohesinмқҳ мң„мғҒм Ғмқё DNA loading мӢӨн—ҳмқ„ in vitroм—җм„ң мһ¬кө¬м„ұн•ҳл©ҙ м•һкіј 비мҠ·н•ң loadingкіј unloading кіјм •м—җм„ңмқҳ DNA м¶ңмһ…м—җ лҢҖн•ң лӢӨлҘё лӘЁлҚёмқҙ лӮҳмҳӨкІҢ лҗңлӢӨ(к·ёлҰј 2). л‘җ л°ҳмқ‘мқҖ ATP к°ҖмҲҳ분н•ҙлҘј нҶөн•ҙм„ң мҙү진лҗҳлҠ”лҚ°, мқҙлҠ” ATPase н—Өл“ңк°Җ н’Җм–ҙм§ҖлҠ” кІғмқҙ DNA м¶ңмһ…мқ„ н•ҳлҠ” л°ҳмқ‘мқҙлқјлҠ” кІғмқҙлӢӨ. Headк°Җ 분н•ҙлҗҳлҠ” кІғмқҖ DNAлҘј cohesinмқҳ ringм—җ л“Өм–ҙк°ҖкІҢ н•ҳкі лӮҳк°ҖкІҢ н•ҳлҠ”лҚ° 충분н•ҳм§Җ м•ҠлӢӨ. Headмқҳ мғҒнҳёмһ‘мҡ©мқҙ kleisin л•Ңл¬ём—җ к°•нҷ”лҗҳкё° л•Ңл¬ёмқҙлӢӨ. DNAмқҳ м¶ңмһ… кіјм • мӨ‘ л‘җ лІҲм§ё мҠӨн…қмқҖ cohesinмқҳ subunitмқё Wap1 (Wings apart-like protein homologue)м—җ мқҳн•ҙ мҙү진лҗңлӢӨ. мқҙ лӢЁл°ұм§ҲмқҖ kleisin N л§җлӢЁмқ„ Smc3(fission yeastм—җм„ңлҠ” Psm3лЎң м•Ңл Өм ё мһҲмқҢ)лЎңл¶Җн„° 분н•ҙмӢңнӮЁлӢӨ. мқҙкІғмңјлЎң kleisin gateк°Җ м—ҙлҰ¬кІҢ лҗңлӢӨ. ATPк°Җ л¶ҷм–ҙ мһҲмқ„ л•Ңм—җ мҰү, headмқҳ мғҒнҳёмһ‘мҡ©мқҙ мһҲмқ„ л•Ңм—җл§Ң Waplмқҙ kleisin N л§җлӢЁмқ„ Psm3лЎңл¶Җн„° 분лҰ¬мӢңнӮЁлӢӨ. мқҙкІғмқҖ DNAк°Җ л‘җ м—°мҶҚм Ғмқё м—°кІ° gateлҘј нҶөкіјн•ҳкі , мқҙкІғмқҙ cohesinмқҳ м¶ңкө¬мҷҖ мһ…кө¬м—ӯн• мқ„ лҸҷмӢңм—җ н•ңлӢӨкі м ңм•Ҳн•ңлӢӨ.
к·ёлҰј 2. a. Cohesin ringмңјлЎңмқҳ DNAк°Җ л“Өм–ҙмҳ¬ л•ҢлҠ” cohesin ringмқҳ м ‘нһҳмқҙ н•„мҡ”н• мҲҳ мһҲлӢӨ. мҳҲлҘј л“Өл©ҙ, л‘җ к°ңмқҳ Smc3 headм—җ л…ём¶ңлҗң lysine residue(KлЎң н‘ңмӢңлҗЁ)л“Өмқҙ DNAм—җ м ‘мҙүмқҙ лҗңлӢӨ. DNA м ‘мҙүмқҖ ATP к°ҖмҲҳ분н•ҙлҘј мқјмңјнӮӨкі , мқҙкІғмқҖ DNAлҘј л‘җ ATPase head мӮ¬мқҙмқҳ к°ӯмқ„ нҶөкіјн•ҳкІҢ н•ңлӢӨ. DNAк°Җ cohesin ringм—җ л“Өм–ҙк°ҖлҠ” кІғмқ„ л§Ҳл¬ҙлҰ¬ н•ҳкё° мң„н•ҙ wapl (Wings apart-like protein homologue)мқҙ Ssc1мқҳ N л§җлӢЁмқҙ Smc3лЎңл¶Җн„° л–Ём–ҙм§ҖлҠ” кІғмқ„ мҙү진мӢңнӮӨкё° м „к№Ңм§Җ мқҙ ATPase headлҠ” лӢӨмӢң ATPк°Җ л¶ҷмқҢмңјлЎң лӢӨмӢң л§һл¬јлҰ¬кІҢ лҗңлӢӨ. b. DNAк°Җ лӮҳк°Ҳ л•ҢлҠ” Ring м ‘нһҳмқҙ мҡ”кө¬лҗҳм§Җ м•ҠлҠ”лӢӨ. к·ё мқҙмң лҠ” DNAлҘј м„јм„ңн•ҳлҠ” Lysine residueл“Өмқҙ к·ё л§Ғ м•Ҳм—җм„ң мқҙлҜё м ‘мҙү к°ҖлҠҘн•ҳкё° л•Ңл¬ёмқҙлӢӨ. a мҷҖ 비мҠ·н•ҳкІҢ ATPase headл“Өмқҳ м—°кІ°кіј л§Ғ л°–м—җм„ңмқҳ Scc1-Smc3 кІҢмқҙнҠёлҘј нҶөн•ҙм„ң DNAлҘј к°ҷмқҖ кІҪлЎңлЎң мқҙлҸҷмӢңнӮЁлӢӨ. (Reprinted with permission from Nature publishing group images in a and b.)
мқҙ л‘җ л°©н–ҘмңјлЎңмқҳ DNA мҲҳмҶЎмқҖ ATP к°ҖмҲҳ분н•ҙлҘј мҙү진мӢңнӮӨлҠ” Psm3 н—Өл“ң мң„м—җм„ң DNAлҘј м„јмӢұн•ҳлҠ” Lys residuesлҘј н•„мҡ”лЎң н•ңлӢӨ. мқҙ Lysine residueл“ӨмқҖ cohesin ring м•ҲмӘҪмқ„ н–Ҙн•ҳкі , к№”лҒ”н•ҳкІҢ к·ёкІғл“Өмқ„ мң„м№ҳмӢңмјңм„ң DNAк°Җ лӮҳк°Җкё° мӢңмһ‘н•ҳкІҢ н•ңлӢӨ(к·ёлҰј 2b). DNAк°Җ кІ°н•©лҗҳм–ҙ мһҲлҠ” Rad50 DNA ліөкө¬ лӢЁл°ұм§Ҳмқҳ ATPase headмқҳ crystal кө¬мЎ°лҠ” DNAк°Җ лӮҳк°ҖлҠ” кІғмқҙ мқјм–ҙлӮҳлҠ” лҸҷм•Ҳ, м–ҙл–»кІҢ мІҳмқҢ м ‘мҙүмқҙ мқјм–ҙлӮҳлҠ”м§ҖлҘј ліҙм—¬мӨҖлӢӨ. м–ҙл–»кІҢ к°ҷмқҖ lysine residueл“Өмқҙ DNA entryлҘј мҙү진мӢңнӮӨлҠ”м§ҖлҠ” мўҖ лӘ…нҷ•н•ҳм§Җ м•ҠлӢӨ. DNAлҠ” мғҒлҢҖм ҒмңјлЎң л»Јл»Јн•ҳкі , лҸҷмӢңм ҒмңјлЎң к·ё DNA sensorк°Җ л°”к№Ҙм—җм„ңл¶Җн„° лӢҝмқ„ мҲҳ мһҲмқ„ м •лҸ„лЎң 충분нһҲ лҫ°мЎұн•ҳкІҢ кө¬л¶Җлҹ¬м§Җм§Җ м•ҠлҠ”лӢӨ. м°ЁлқјлҰ¬, к·ё мң м—°н•ң cohesin ringмқҖ residueл“Өмқҙ л…ём¶ңмқҙ лҗ мҲҳ мһҲлҸ„лЎқ м•ҲнҢҺмқҙ л’Ө집нһҲкІҢ м ‘нһҗ мҲҳ мһҲмқ„ кІғмқҙлӢӨ. мқҙлҹ° кө¬мЎ° ліҖнҷ”к°Җ cohesin loader ліөн•©мІҙм—җ мқҳн•ҙ мҙү진мқҙ лҗңлӢӨлҠ” к·јкұ°к°Җ мһҲлӢӨ. мқҙ cohesin loader ліөн•©мІҙлҠ” cohesinмқ„ loadingмқ„ к°ҖлҠҘн•ҳкІҢ н•ҳкі , Scc2мҷҖ Scc4 subunit(fission yeastм—җм„ңлҠ” Mis4мҷҖ Ssl3)мңјлЎң кө¬м„ұлҗҳм–ҙ мһҲлӢӨ. мқҙ ліөн•©мІҙлҠ” cohesinкіј cohesin л§Ғ л‘ҳл Ҳм—җ м—¬лҹ¬ кө°лҚ° м ‘мҙүм җмқҙ мһҲкі , мқҙкІғл“Өмқҙ нҒ° кө¬мЎ°ліҖнҷ”лҘј к°ҖлҠҘн•ҳкІҢ н• кІғ к°ҷлӢӨ. DNAк°Җ л°–м—җм„ңл¶Җн„° н•ңлІҲ м ‘нҳҖ진 cohesin л§Ғ мң„м—җ мһҲлҠ” к·ё м„јм„ңм—җ л§һл¬јлҰ¬л©ҙ, к°ҷмқҖ кІҪлЎңмқё ATPaseмҷҖ kleisin кІҢмқҙнҠёлЎң DNAк°Җ л“Өм–ҙм„ңкІҢ лҗңлӢӨ. мқҙ лӘЁлҚёмқҖ лҳҗн•ң мқҙм „ лӢЁл°ұм§Ҳ engineering м ‘к·ј л°©мӢқмңјлЎң кҙҖм°°лҗҳм—ҲлҚҳ кІғмңјлЎң м„ӨлӘ…мқҙ к°ҖлҠҘн•ҳлӢӨ. Kleisin м ‘мҙү л¶Җ분мқ„ лҙүмқён•ҳл©ҙ мқҙкІғмқҖ DNAмқҳ exitлҘј л§үмқ„ мҲҳлҠ” мһҲм–ҙлҸ„, ATPase gateлҘј нҶөн•ң мң„мғҒм Ғмқё DNA entryлҘј л§үм§Җ лӘ»н•ҳкІҢ лҗңлӢӨ.
к·ё DNAк°Җ лӢӨлҘё SMC ліөн•©мІҙл“Өм—җм„ң л“Өм–ҙмҳӨкі лӮҳмҳӨлҠ” кІғмқҖ л§Өмҡ° 비мҠ·н•ң кіјм •мқ„ к°Җ진лӢӨ. м ‘нһҳ кө¬мЎ°лҘј нҶөн•ҙм„ң DNAк°Җ л“Өм–ҙмҳӨлҠ” кІғмқҙ мҙү진лҗҳлҠ” кІғмқҖ мӣҗмһҗнһҳ нҳ„лҜёкІҪ(atomic force micros, AFM)м—җм„ң fission yeastмқҳ cohesin SMC dimerкіј condesin ліөн•©мІҙм—җм„ң ліҙм—¬мЎҢлӢӨ. Cohesin headмҷҖ SMC hingeмҷҖ кІ°н•©лҗң Subunitл“Өмқҳ к°Җк№Ңмҡҙ кұ°лҰ¬лҠ” мӮҙм•„мһҲлҠ” budding yeastм—җм„ң FRET (fluorescence resonance energy transfer)лЎң кҙҖм°°лҗҳм—ҲлӢӨ. л°ҳл©ҙ, Smc5-Smc6 ліөн•©мІҙмқҳ Nse5 (non-SMC element 5)мҷҖ Nse6 subunitл“ӨмқҖ н—Өл“ңмҷҖ hinge лӘЁл‘җм—җ л¶ҷлҠ”лӢӨкі ліҙкі лҗҳм—ҲлӢӨ. к°ҷмқҖ лӘЁлҚёмқҖ prokaryotic SMC ліөн•©мІҙм—җ мқҙмҡ©лҗ мҲҳ мһҲлӢӨ. мқҙ лӘЁлҚёмқҳ мӨ‘мҡ”н•ң м җмқҖ DNAк°Җ SMC ringмңјлЎңл¶Җн„° к°Җ둬м§ҖлҠ” кІғмқҙ л‘җ лІҲм§ё DNAк°Җ л“Өм–ҙмҳӨлҠ” кІғмқ„ л§үм§Җ лӘ»н•ңлӢӨлҠ” кІғмқҙлӢӨ. мӮ¬мӢӨ, к·ё л¬јлҰј кІҢмқҙнҠё кё°мһ‘мқҖ л‘җ лІҲм§ё DNAк°Җ л“Өм–ҙмҳӨлҠ” лҸҷм•Ҳ мІ« лІҲм§ё DNAлҘј лҶ“м№ҳм§Җ м•ҠлҠ”лӢӨлҠ” кІғмқ„ нҷ•мӢӨн•ҳкІҢ н•ңлӢӨ. м–ҙл–»кІҢ SMC ліөн•©мІҙк°Җ н•ң к°ң мқҙмғҒмқҳ DNA 분мһҗлҘј м—°кІ°н•ҳлҠ”м§ҖлҘј мқҙн•ҙн•ҳлҠ” мӨ‘мҡ”м„ұмқҖ DNA м—°кІ°(linkage)мқ„ in vitroлЎң м—°кө¬н•ҳлҠ”лҚ° мҳҒк°җмқ„ мӨҖлӢӨ. м•һмңјлЎң SMC ліөн•©мІҙк°Җ н•ң к°ң мқҙмғҒмқҳ DNA к°ҖлӢҘмқ„ мһЎлҠ”м§Җ м•„лӢҢм§ҖмҷҖ м–ҙл–»кІҢ к·ёл ҮкІҢ н•ҳлҠ”м§ҖлҘј м—°кө¬н•ҳкё° мң„н•ҙ мӢӨн—ҳл°©лІ•мқ„ кі м•Ҳн•ҳлҠ” кІғмқҙ мӨ‘мҡ”н•ҙм§Ҳ кІғмқҙлӢӨ.
5. мғқмІҙ лӮҙ(in vivo)м—җм„ңмқҳ SMC ліөн•©мІҙмқҳ м—јмғүмІҙ кІ°н•©
SMC ліөн•©мІҙл“Өмқҙ м—јмғүмІҙм—җ м–ҙл–»кІҢ м—ӯн• мқ„ н•ҳлҠ”м§Җм—җ лҢҖн•ң мқҙн•ҙлҠ” кІҢлҶҲм—җ л¶ҷлҠ” нҢЁн„ҙмқ„ 분м„қн•ЁмңјлЎң лӮҳмҳ¬ мҲҳ мһҲлӢӨ
5.1 м—јмғүмІҙлҘј л”°лқј мһҲлҠ” loading мӮ¬мқҙнҠёл“Ө
лӘЁл“ SMC ліөн•©мІҙл“ӨмқҖ лҸҷмӣҗмІҙ к·јмІҳм—җ л°Җ집лҗҳм–ҙ мһҲлӢӨ. к·ёлҰ¬кі м—јмғүмІҙ нҢ”м—җлҠ” мӮ°л°ңм ҒмңјлЎң 분нҸ¬лҗҳм–ҙ мһҲлӢӨ. Cohesinмқҳ лҸҷмӣҗмІҙм—җ л°Җ집лҗҳм–ҙ мһҲлҠ” кІғмқҖ л”ё chromatid мҢҚмқ„ bi-orientationмңјлЎң л§Ңл“ңлҠ”лҚ° мӨ‘мҡ”н•ҳл©°, mitotic spindleмқҳ лӢ№кё°лҠ” нһҳмқ„ м„ңлЎң нҢҪнҢҪн•ҳкІҢ мң м§ҖмӢңнӮӨл©ҙм„ң м„ңлЎң лӢ№кІЁмӨҖлӢӨ. Condensinмқҙ лҸҷмӣҗмІҙм—җ л°Җ집лҗҳм–ҙ мһҲлҠ” кІғмқҖ лҸҷмӣҗмІҙ chromatinмқҳ microtubule л¶Җм°© л¶Җ분мқҳ л¬јлҰ¬м Ғмқё м•Ҳм •к°җмқ„ мң мӮ¬л¶„м—ҙм—җм„ң мЈјкё° мң„н•ЁмқҙлӢӨ. к·ёлҹј л¬ҙм—Үмқҙ мқҙ лӢЁл°ұм§Ҳл“Өмқҳ loading siteлҘј кІ°м •н• к№Ң? Budding yeastмқҳ кІҪмҡ°м—җлҠ”, м•Ҳ мӘҪмқҳ kinetochore COMA ліөн•©мІҙмҷҖ Cdc7-Dbf4 kinaseк°Җ cohesinмқҙ лҸҷмӣҗмІҙм—җ 집мӨ‘лҗҳлҸ„лЎқ м§Ғм ‘м ҒмңјлЎңлӮҳ к°„м ‘м ҒмңјлЎңлӮҳ cohesin loaderмқё Scc2-Scc4лҘј лҸҷмӣҗн•ҳкІҢ н•ңлӢӨ. к·ёлҹј м–ҙл–»кІҢ мқҙ loaderлҠ” cohesinмқ„ лӢӨлҘё м—јмғүмІҙм—җ 비н•ҙ мқҙ мӨ‘мӢ¬л¶Җм—җ loadingмқҙ лҗҳлҸ„лЎқ мҙү진мӢңнӮӨлҠ”к°Җ? мқҙ к°ҷмқҖ loaderк°Җ condensinкіј SMC5/6 ліөн•©мІҙлҘј loading н•ҳлҠ”лҚ° кҙҖм—¬н•ҳлҠ”м§ҖлҠ” м•„м§Ғ лӘЁлҘёлӢӨ. Budding yeastм—җм„ң Condensinмқҙ мӨ‘мӢ¬лҰҪм—җ лӘЁм—¬мһҲлҠ” кІғмқҖ мӨ‘мӢӯлҰҪ ліҙнҳём ңмқё shugoshinм—җ мқҳн•ҙм„ң мҙү진мқҙ лҗңлӢӨ. мқҙ кё°мһ‘лҸ„ м•„м§Ғ лӘЁлҘёлӢӨ.
Cohesin лҳҗлҠ” condensinмқҳ loadingмқҖ лҰ¬ліҙмўҖ лӢЁл°ұм§Ҳкіј t-RNA мң м „мһҗ к°ҷмқҖ м•„мЈј л§Һмқҙ л°ңнҳ„лҗҳлҠ” мң м „мһҗмқҳ promoterм—җм„ң мқјм–ҙлӮңлӢӨ. Budding yeastмқҳ кІҪмҡ°м—җлҠ” RSC (remodels the structure of chromatin) ліөн•©мІҙк°Җ Scc2-Scc4 ліөн•©мІҙм—җ л¶ҷлҠ” кІғмқҙ мӨ‘мҡ”н•ҳлӢӨ. Scc4к°Җ лҚ” мӨ‘мҡ”н• кІғмңјлЎң ліҙмқҙлҠ”лҚ° мқҙкІғмқҖ chromatinмқ„ Scc2-Scc4 ліөн•©мІҙм—җ л¶ҷкІҢ н•ҳлҠ”лҚ°, in vitroм—җм„ңлҠ” мҲңмҲҳ DNAм—җ loading н•ҳл Өкі н• л•Ңм—җлҠ” н•„мҡ”к°Җ м—ҶлӢӨ. Scc4 м„ңлёҢмң лӢӣмқҖ cohesin loaderмқҳ chromatin м–ҙлҢ‘н„°лЎң ліҙм—¬м§Җкі , л°ҳл©ҙ Scc2лҠ” м§Ғм ‘ cohesinкіј м ‘мҙүн•ҙм„ң loadingмқ„ лҗҳкІҢ н•ңлӢӨ. мІҷ추лҸҷл¬јм—җлҠ” лӢӨм–‘н•ң cohesinмқҳ лҸҷнҳ•лӢЁл°ұм§Ҳл“Өмқҙ мһҲлӢӨ. мқҙкІғл“ӨмқҖ SCC3 м„ңлёҢмң лӢӣмқҳ paralogueмқё SA1 лҳҗлҠ” SA2мҷҖ мһҗл§Ө chromatid кІ°н•© лӢЁл°ұм§Ҳ PDS5 homologue A (PDS5A) лҳҗлҠ” PDS5BлҘј к°Җм§Җкі мһҲлӢӨ. л°ҳл©ҙ SA1мқҙ мһҲлҠ” cohesinмқҖ н…”лЎңлҜём–ҙ мЈјліҖм—җ л§Һмқҙ мһҲкі , SA2лҘј нҸ¬н•Ён•ҳлҠ” cohesinмқҖ мўҖ лҚ” мӨ‘мӢ¬лҰҪм—җ лӘЁм—¬ мһҲлӢӨ. PDS5Bк°Җ л“Өм–ҙ мһҲлҠ” cohesinмқҖ мӨ‘мӢ¬лҰҪм—җ нҠ№мқҙм Ғмқё кё°лҠҘмқ„ к°Җ진лӢӨ. мқҙл ҮкІҢ лӢӨлҘё cohesin ліөн•©мІҙк°Җ лӢӨлҘё мң„м№ҳлҘј м •н•ҳлҠ” кё°мһ‘мқҖ м•„м§Ғ мһҳ мқҙн•ҙлҗҳм§Җ м•Ҡм•ҳлӢӨ.
Condensinмқ„ мһҘм°©мӢңнӮӨлҠ” мӮ¬мқҙнҠёлҠ”, budding yeast, fission yeastмҷҖ C. elegansм—җм„ң лҢҖл¶Җ분мқҳ кІҪмҡ°м—җ, cohesinмқҳ мһҘм°©н•ҳлҠ” кіікіј 비мҠ·н•ң кІғмІҳлҹј ліҙмқёлӢӨ. Condensinкіј cohesin loaderмқҳ м§Ғм ‘м Ғмқё лӢЁл°ұм§Ҳ мғҒнҳёмһ‘мҡ©мқҙ кҙҖм°°лҗҳм§Җ м•Ҡм•ҳм–ҙлҸ„, budding yeastм—җм„ң cohesin loaderлҠ” condensin мһҘм°©мқ„ мҙү진мӢңнӮЁлӢӨ. Condensinкіј TFIIIC м „мӮ¬ мқёмһҗ ліөн•©мІҙмҷҖмқҳ мғҒнҳёмһ‘мҡ©мқҖ budding yeast condensinмқҙ tRNA мң м „мһҗлҘј нғҖкІҹнҢ…н•ҳкІҢ н•ҳкі , condensinкіј monopolin ліөн•©мІҙмқҳ мғҒнҳёмһ‘мҡ©мқҖ мқҙ condensinмқҙ лҰ¬ліҙмҶң DNA (rDNA)лҘј нғҖкІҹнҢ…н•ҳкІҢ н•ңлӢӨ. Fission yeastмқҳ condensinмқҙ TFIIICкіј TATA-boxм—җ л¶ҷлҠ” лӢЁл°ұм§Ҳ(TBP)кіј мғҒнҳёмһ‘мҡ©мқҖ н•ҳлҠ” кІғмқҖ мқҙ мғқл¬јм—җм„ң condensin мһҘм°©м—җ кіөн—Ңн•ңлӢӨ. лӢӯкіј мқёк°„мқҳ condensin I ліөн•©мІҙл“ӨмқҖ л§Һмқҙ л°ңнҳ„лҗҳлҠ” мң м „мһҗмқҳ promoterм—җм„ң л§Һмқҙ л°ңкІ¬мқҙ лҗңлӢӨ. м–ҙл–»кІҢ condensinмқҙ мқҙлҹ° promoterл“Өм—җ л°ңнғҒмқҙ лҗҳлҠ”м§Җ, нҠ№нһҲ мң мӮ¬л¶„м—ҙм—җм„ң м–ём ң м „мӮ¬к°Җ мӨ‘м§Җлҗҳкі , м–ҙл–»кІҢ мІҷ추лҸҷл¬јм—җм„ңмқҳ лӢӨлҘё condensin 1мҷҖ condensin 2 ліөн•©мІҙк°Җ лӢӨлҘё patternмқ„ лӮҳнғҖлӮҙлҠ”м§ҖлҠ” м•„м§ҒлҸ„ мһҳ лӘЁлҘёлӢӨ. м—ҙлҰ° promoterлҠ” free DNAлҘј SMC ліөн•©мІҙ л¶Җм°©нӢҖлЎң к°„мЈјн•ңлӢӨ. Budding yeastк°Җ м•„лӢҢ лӢӨлҘё мғқл¬јм—җм„ңлҸ„, RSC ліөн•©мІҙ лҳҗлҠ” н”„лЎңлӘЁн„° nucleosomeмқ„ м ңкұ°н•ҳлҠ” лӢӨлҘё chromatin лҰ¬лӘЁлҚёлҹ¬к°Җ cohesin лҳҗлҠ” condensin loading мң„м№ҳлҘј м§Җм •н•ҳлҠ”лҚ° м—ӯн• мқ„ н•ҳлҠ”м§ҖлҠ” лҚ” мЎ°мӮ¬н•ҙм•ј н•ңлӢӨ. SMC ліөн•©мІҙмқҳ лҰ¬ліҙмҶң лӢЁл°ұм§Ҳкіј tRNA мң м „мһҗм—җ л¶ҷлҠ” кІғмқҖ л°•н…ҢлҰ¬м•„м—җм„ңлҸ„ л°ңкІ¬мқҙ лҗҳм—ҲлҠ”лҚ° мқҙкІғмқҖ SMC ліөн•©мІҙмқҳ л¶Җм°© мӮ¬мқҙнҠёлҘј кІ°м •н•ҳлҠ” кё°мһ‘мқҙ кё°ліём ҒмңјлЎң ліҙмЎҙлҗҳм–ҙ мһҲмқҢмқ„ м ңм•Ҳн•ңлӢӨ.
5.2 SMC ліөн•©мІҙмқҳ loading мқҙнӣ„мқҳ мқҙлҸҷ
н•өмӢ¬ мӨ‘мӢ¬лҰҪм—җм„ң SMC ліөн•©мІҙк°Җ loadingлҗң лӢӨмқҢм—җ, budding yeast cohesinмқҖ к·ё loading мӮ¬мқҙнҠём—җм„ң м•һмңјлЎң кі„мҶҚ лЁёл¬јлҹ¬ мҲҳл ҙ м „мӮ¬ мў…кІ°(convergent tranional termination) мң„м№ҳлЎң мқҙлҸҷн•ҳлҠ” кІғмІҳлҹј ліҙмқёлӢӨ. м „мӮ¬ нҷңм„ұ мқҙнӣ„ мң м „мһҗлҘј л”°лқј slidingн•ҳкі мһҲлҠ” cohesinмқҳ мӨ‘к°„ мғҒнғңлҘј кҙҖм°°н•ҳкё° л•Ңл¬ём—җ cohesinмқҙ chromatinмқ„ л”°лқј мң„мғҒм Ғмқё м ‘мҙүмқҙ мһҲлҠ” мғҒнғңм—җм„ң лҜёлҒ„лҹ¬м§Җл“Ҝмқҙ мӣҖм§ҒмқёлӢӨкі н•ҙм„қн•ҳкі мһҲлӢӨ. Fission yeast cohesinмқҖ мқҙ мӢңлӮҳлҰ¬мҳӨмҷҖ мқјм№ҳлҗң 분нҸ¬лҘј ліҙмқёлӢӨ. Cohesin loader мӮ¬мқҙнҠём—җм„ң м•Ҫк°„мқҳ cohesinмқҙ кҙҖм°°мқҙ лҗҳкі , лҢҖл¶Җ분мқҖ мҲҳл ҙ м „мӮ¬ мў…кІ°мһҗм—җм„ң л°ңкІ¬мқҙ лҗңлӢӨ. мқҙ мғҒнҷ©мқҖ Drosophila melanogasterм—җм„ңлҠ” лӢӨлҘҙкІҢ кҙҖм°°мқҙ лҗңлӢӨ. Cohesinкіј мқҙкІғмқҳ loader л‘ҳ лӢӨ лӘЁл‘җ нҷңм„ұнҷ”лҗң мң м „мһҗ promoterмҷҖ м „мӮ¬лҗҳлҠ” мң м „мһҗлҘј л”°лқј л°ңкІ¬мқҙ лҗңлӢӨ. мқҙкІғмқҖ loaderмҷҖ cohesinмқҙ loadingкіј мғҒлӢ№н•ҳкІҢ мӣҖм§Ғмқј л•Ң лҚ” нҡЁлӘЁліҙлӢӨ нҢҢлҰ¬м—җм„ң кёҙл°Җн•ҳкІҢ м—°кІ°лҗҳм–ҙ мһҲлӢӨлҠ” кІғмқ„ ліҙмқҙлҠ” кІғмқҙлӢӨ.
мқёк°„ м„ёнҸ¬м—җм„ңлҠ”, л§ҺмқҖ мӨ‘мҡ”н•ң cohesinмқҙ 축мІҷлҗҳлҠ” кіімқҙ м „мӮ¬ мЎ°м Ҳ CTCFмҷҖ мқјм№ҳн•ҳлҠ” кІғмқ„ ліҙмҳҖлӢӨ. к·ёлҰ¬кі мқҙ кіімқҖ cohesinмқҳ loadingлҗҳлҠ” кіікіјлҸ„ лӢ¬лһҗлӢӨ. мқёк°„ cohesinмқҙ promoterм—җм„ңл¶Җн„° CTCFк°Җ л¶ҷм–ҙ мһҲлҠ” кіік№Ңм§Җ мӣҖм§ҒмқҙлҠ”м§Җ, к·ёлҰ¬кі м–ҙл–»кІҢ мӣҖм§ҒмқҙлҠ”м§ҖлҠ” м•„м§Ғ м•Ңл Өм§Җм§Җ м•Ҡм•ҳлӢӨ. RNA мӨ‘н•© нҡЁмҶҢ IIк°Җ cohesinмқҳ мӣҖм§Ғмһ„мқ„ л§Ңл“Ө к°ҖлҠҘм„ұмқҙ мһҲлӢӨ. мқҙкІғмқҖ ліҙнҶө 분лӢ№ мҲҳ kbлЎң мӣҖм§ҒмқёлӢӨ. мқёк°„ мң м „мһҗмқҳ кёёмқҙк°Җ мЈјм–ҙм§Җкі , cohesinмқҙ м—јмғүмІҙм—җ нҸүк· лЁёл¬ҙлҠ” мӢңк°„мқ„ ліҙл©ҙ, лҢҖл¶Җ분мқҳ cohesinмқҖ мқёк°„ мң м „мһҗмқҳ лҒқк№Ңм§Җ к°Җкё°м—җлҠ” л¶Ҳк°ҖлҠҘн• кІғмқҙлқј ліҙмқёлӢӨ. м•„м„ёнӢёнҷ”лҗң cohesinмқҖ м—јмғүмІҙм—җ лҚ” кёёкІҢ лЁёл¬ёлӢӨ. к·ёлҰ¬кі мқҙкІғмқҖ 짧мқҖ мң м „мһҗмқҳ 3лІҲ лҒқ л§җлӢЁм—җ 축мІҷмқҙ лҗҳлҠ” кІғмқҙ кҙҖм°°мқҙ лҗҳм—Ҳкі , мқҙкІғмқҖ м „мӮ¬лҗҳлҠ” мң м „мһҗлҘј л”°лқј мқёк°„ мң м „мһҗк°Җ лҜёлҒ„лҹ¬м§Җл“Ҝ мӣҖм§ҒмқёлӢӨкі ліҙ여진лӢӨ.
CondensinлҸ„ 비мҠ·н•ҳкІҢ loadingн•ҳлҠ” кіім—җм„ңл¶Җн„° м „мӮ¬лҗҳлҠ” л°©н–ҘмңјлЎң мӣҖм§Ғмқј кІғ к°ҷлӢӨ. мөңк·ј fission yeast condensinмқҳ мҙҲкі н•ҙмғҒлҸ„ mapм—җм„ң кҙҖм°°лҗң, promoter лЎңл”© мӮ¬мқҙнҠёмҷҖ л°ңнҳ„лҗҳлҠ” мң м „мһҗ 3 лІҲ л§җлӢЁм—җ л§Һмқҙ 분нҸ¬лҗң лӘЁмҠөмқ„ ліҙм—¬мЈјлҠ” мҢҚлҙү 분нҸ¬(bimodal distribution)к°Җ мқҙ к°ҖлҠҘм„ұмқ„ мқҙм•јкё°н•ҳкі мһҲлӢӨ. лҚ” л№ лҘё 분н•ҙмҷҖ лӢӨмӢң лЎңл”©лҗҳлҠ” мҶҚлҸ„лҠ” condensinмқҙ м–ём ңлӮҳ мң м „мһҗмқҳ лҒқк№Ңм§Җ лҸ„лӢ¬н•ҳм§Җ м•ҠлҠ”лӢӨлҠ” кІғмқ„ мқҙм•јкё°н•ңлӢӨ. к·ёлҰ¬кі condensinмқҖ лЎңл”© мӮ¬мқҙнҠёмҷҖ м „мӮ¬лҗҳлҠ” кіім—җм„ң лӘЁл‘җ кҙҖм°°мқҙ к°ҖлҠҘн•ҳлӢӨ.
Buddingкіј fission yeastмқҳ Smc5-Smc6 ліөн•©мІҙмқҳ 분нҸ¬лҠ” cohesinмқ„ л”°лқјк°„лӢӨ. мқҙкІғмқҖ м—јмғүмІҙм—җ лЎңл”©лҗҳкі , 분нҸ¬н•ҳлҠ” кё°мһ‘мқҙ лӘЁл“ SMC ліөн•©мІҙк°Җ 비мҠ·н•ң кІғмІҳлҹј ліҙ여진лӢӨ. Smc5-Smc6лҠ” мқҙкІғмқҳ мң мқјн•ң нҠ№м§•мқҙ мһҲлӢӨ. Budding yeastм—җм„ңлҠ” мқҙкІғмқҖ DNA ліөм ң л•Ң DNA лЎңл”©мқҙ лҗҳкі , мқҙкІғмқҳ м •лҹүм Ғмқё лЎңл”©мқҖ м—јмғүмІҙмқҳ кёёмқҙмҷҖ мң„мғҒм—җ ліҖнҷ”лҘј л°ҳмҳҒн•ңлӢӨ. мқҙкІғмқҖ Smc5-Smc6 ліөн•©мІҙмқҳ лЎңл”©мқ„ кІ°м •н•ҳлҠ” кё°мһ‘мқҙ мӨ‘мҡ”н•ң м—°кө¬мЈјм ңмһ„мқ„ ліҙмқҙлҠ” кІғмқҙлӢӨ. мқҙкІғкіј н•Ёк»ҳ, мң„мғҒм Ғмқё лЎңл”©кіј м—јмғүмІҙмқҳ мёЎл©ҙмқ„ л”°лқј мӣҖм§ҒмқҙлҠ” лҠҘл ҘмқҖ SMC ліөн•©мІҙмқҳ кіөнҶө кё°мһ‘мІҳлҹј ліҙмқёлӢӨ. мқҙкІғмқҖ SMC л§Ғмқҙ DNAлҘј м•Ҳм •м ҒмңјлЎң к°җмӢёкі , мӨ‘мҡ”н•ң кө¬мЎ° кё°лҠҘмқ„ н•ҳл©° мқҙ мқјмқҖ к°ҷмқҖ мӢңнҖҖмҠӨлҘј л”°лқј мқјм–ҙлӮҳлҠ” лӢӨлҘё м—јмғүмІҙ нҷңлҸҷмқ„ л°©н•ҙн•ҳлҠ” кІғ м—Ҷмқҙ мқјм–ҙлӮңлӢӨ.
6. мқ‘축과 resolutionм—җм„ңмқҳ Condensin
мң„мғҒм ҒмңјлЎң DNA fiberлҘј к°җмӢёкі , мҲңм„ңм ҒмңјлЎң н•ҳлӮҳ мқҙмғҒмқҳ DNAк°Җ entrapmentлҗҳл©ҙ мқҙкІғмңјлЎң мқҙлҜё м•Ңл Ө진 SMC ліөн•©мІҙл“Өмқҳ кё°лҠҘмқ„ м„ӨлӘ…н• мҲҳ мһҲмқ„к№Ң?
Cohesin ліөн•©мІҙлҠ” к°Җк№Ңмҡҙ binding site л“Өмқҳ л¬јлҰ¬м Ғмқё мғҒнҳёмһ‘мҡ©мқ„ мҙү진мӢңнӮЁлӢӨкі м•Ңл Өм ё мһҲлӢӨ. мқҙкІғмңјлЎң DNAлҘј crosslinking н•ҳлҠ” лҠҘл Ҙмқ„ ліҙмқҙлҠ” SMC ліөн•©мІҙмқҳ мҳҲк°Җ лҗҳм—ҲлӢӨ. Condensin binding sitesмқҳ н•ө м•Ҳмқҳ clusteringмқҖ condensinм—җ мқҳмЎҙлҗҳм–ҙ мһҲкі , мқҙкІғмқҖ DNA crosslinkerмҷҖ к°ҷмқҖ м—ӯн• мқ„ н•ңлӢӨкі м ңм•ҲлҗңлӢӨ. Condensinмқ„ л°•н…ҢлҰ¬м•„м—җм„ң мӮ¬лһҢ м„ёнҸ¬к№Ңм§Җ inactivationмқ„ мӢңнӮӨл©ҙ anaphaseм—җм„ң phenotypeмқҖ chromosome мқ‘축мқҙ мӢӨнҢЁлҗҳкұ°лӮҳ, л‘җ к°ңмқҳ sister chromatidлҘј resolveн•ҳм§Җ лӘ»н•ҳкІҢ лҗңлӢӨ. мқҙкІғмқҖ chromosome bridgeлЎңлҸ„ мқҙм–ҙ진лӢӨ.
6.1 м—јмғүмІҙ мқ‘축
көҗкіјм„ңм—җм„ңлҠ” м—јмғүмІҙ мқ‘축мқҙ кі„мёөм Ғмқё coilingмңјлЎң мқҙлӨ„мЎҢлӢӨкі м„ӨлӘ…н•ңлӢӨ. лЁјм ҖлҠ” DNAм—җ к°Җм„ң nucleosomeмқ„ л‘ҳлҹ¬мӢёкі , мқҙ Nucleosomeмқҳ кі м°Ёмӣҗ fiberлЎң лҗҳм–ҙ м—јмғүмІҙлҘј кө¬м„ұн•ҳлҠ” лЈЁн”„лҘј л§Ңл“ӨкІҢ лҗңлӢӨ. CondensinмқҖ мқҙ лӘЁлҚём—җм„ңлҠ” лӢЁл°ұм§ҲлЎң мқҙлЈЁм–ҙ진 м—јмғүмІҙ scaffoldлҘј нҳ•м„ұн•ЁмңјлЎң DNA лЈЁн”„л“Өмқ„ кі м •мӢңнӮЁлӢӨ(к·ёлҰј 3a). н•ҳм§Җл§Ң, м–ҙл–»кІҢ condensinмқҙ мқҙ scaffoldлҘј л§Ңл“Өм–ҙлӮҙлҠ”м§Җм—җ лҢҖн•ң 분мһҗ м„ӨлӘ…мқҖ м•„м§Ғ лӘ…нҷ•н•ҳм§Җ м•ҠлӢӨ. лҳҗн•ң, scaffoldлӮҳ 10 nm nucleosome fiberліҙлӢӨ нҒ° л°ҳліөм Ғмқё кө¬мЎ°лҠ” м—јмғүмІҙ кө¬мЎ°м—җ лҢҖн•ң мғқл¬јл¬јлҰ¬н•ҷкіј мҙҲлҜём„ё кө¬мЎ°м—°кө¬м—җм„ңлҠ” м•„м§Ғ л°ңкІ¬мқҙ лҗҳм§Җ м•Ҡм•ҳлӢӨ. лҳҗн•ң, nucleosomeмқҙ 30 nmмқҳ fiberлЎң л°°м—ҙлҗңлӢӨлҠ” н•ң л•Ң мқёкё° мһҲм—ҲлҚҳ м•„мқҙл””м–ҙлҸ„ м•„м§Ғ мҰқкұ°к°Җ л°ңкІ¬лҗҳм§ҖлҠ” м•Ҡм•ҳлӢӨ. л°ҳл©ҙ condensinмқҖ 10 nm fiberлЎң ліҙмқҙлҠ” көҗм°Ё л¶Җ분м—җм„ң л°ңкІ¬мқҙ лҗҳм—ҲлӢӨ. мқҙкІғмқҖ condensinмқҙ мһҗмң лЎӯкІҢ нҷ•мӮ°лҗҳлҠ” 10 nm м—јмғүм§Ҳ 섬мң мӮ¬мқҙмқҳ нҷ•лҘ м Ғ к°Җкөҗ кІ°н•©м ң(stochastic crosslinker)лЎң кё°лҠҘн•ЁмңјлЎңмҚЁ м—јмғүмІҙлҘј нҳ•м„ұн•ңлӢӨлҠ” лҳҗ лӢӨлҘё лӘЁлҚёмқ„ мқҙлҒҢм–ҙ лғҲлӢӨ. Nucleosome fiberм—җ лҢҖн•ң Brownian лҸҷм—ӯн•ҷ мӢң뮬л Ҳмқҙм…ҳм—җм„ңл¶Җн„° condensin м ‘мҙү л¶Җмң„ мӮ¬мқҙм—җм„ң нҷ•лҘ м ҒмңјлЎң мҢҚмңјлЎң мһ‘мҡ©н•ҳлҠ” мғҒнҳёмһ‘мҡ©мңјлЎң м ңн•ңлҗң мғҒнғңм—җм„ңмқҳ budding yeast м—јмғүмІҙмқҳ мӮ¬мқҙмҰҲлЎңл¶Җн„° м—јмғүмІҙмқҳ н–үлҸҷмқ„ мӢң뮬л Ҳмқҙм…ҳ н–Ҳкі , мқҙкІғмқҖ м„ёнҸ¬ м•Ҳм—җм„ңмқҳ budding yeast м—јмғүмІҙмқҳ нҠ№м§•кіј м•„мЈј мһҳ мқјм№ҳн–ҲлӢӨ(к·ёлҰј 3b). лӢӨм–‘н•ң м—јмғүмІҙ кө¬м„ұ мҡ”мҶҢл“Ө мӮ¬мқҙм—җм„ң л°ңмғқн•ҳлҠ” мҲҳл§ҺмқҖ мғҒнҳёмһ‘мҡ©м—җ лҢҖн•ҙ нӢҖлҰјм—Ҷмқҙ м§ҖлӮҳм№ҳкІҢ лӢЁмҲңнҷ” мӢңмј°м§Җл§Ң, мӢң뮬л Ҳмқҙм…ҳмқҖ к°„лӢЁн•ң к°Җм •мқҙ м—јмғүмІҙмқҳ н–үлҸҷмқ„ м„ӨлӘ…н•ҳлҠ”лҚ° л§ҺмқҖ лҸ„мӣҖмқҙ лҗЁмқ„ ліҙм—¬мӨҖлӢӨ. к·ёл“ӨмқҖ м—јмғүмІҙмқҳ лӮҙл¶Җк°Җ м–ҙл–»кІҢ ліҙмқјм§Җм—җ лҢҖн•ң мӨҖ-분мһҗм ҒмңјлЎң м–јн•Ҹ ліҙкІҢ н•ңлӢӨ. лҚ” нҒ° м—јмғүмІҙк°Җ 비көҗм Ғ лӢЁмҲңн•ң лӘЁлҚёл“Өм—җ мқҳн•ҙ мқҙн•ҙлҗ мҲҳ мһҲмқ„м§Җ, мқёк°„ м—јмғүмІҙ лӘЁм–‘мқ„ к°–кё° мң„н•ҙ м–ҙл–Ө 추к°Җ мЎ°м§Ғ мӣҗлҰ¬к°Җ нҸ¬н•Ёлҗҳм–ҙм•ј н•ҳлҠ”м§ҖлҘј ліҙлҠ” кІғмқҖ нқҘлҜёлЎңмҡё кІғмқҙлӢӨ. мқҙ л°©н–Ҙм—җм„ң к°ҖмһҘ мӨ‘мҡ”н•ң milestoneмқҖ мІҷ추 м—јмғүмІҙ кө¬мЎ°лҘј м •м ңн•ң кө¬м„ұл¬јлЎңл¶Җн„° мһ¬кө¬м„ұн–ҲлӢӨлҠ” кІғмқҙлӢӨ. мқҙлҠ” condensinмқҙ histone мғӨнҺҳлЎ кіј topoisomerase IIк°Җ м ңкіөн•ҳлҠ” DNA к°ҖлӢҘ нҶөкіј нҷңм„ұмқҙ X. laevis egg 추м¶ңл¬јм—җм„ң м •мһҗ м—јмғүм§Ҳм—җм„ң нҳ•м„ұлҗң м—јмғүмІҙмҷҖ мң мӮ¬н•Ёмқ„ ліҙм—¬мЈјм—ҲлӢӨ.
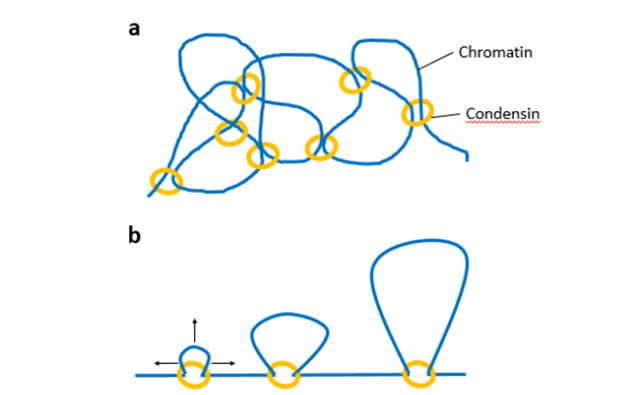
к·ёлҰј 3. a. м—јмғүм§Ҳ(chromatin) мІҙмқёмқҳ лҸ„мӢқ н‘ңнҳ„. м—јмғүм§Ҳл“ӨмқҖ Stochasticн•ҳкІҢ м§қмңјлЎң мқҙлӨ„진 condensin кІ°н•© мӮ¬мқҙнҠёл“Өмқҳ м ‘мҙү л¶Җ분мңјлЎң м ңн•ңлҗҳм—ҲлӢӨ. b. Condensinмқҙ м—јмғүмІҙмқҳ мқ‘축мқ„ мң„н•ҙм„ң DNA loopмқ„ л°Җм–ҙлӮёлӢӨлҠ” лӘЁлҚё.
лӢӨлҘё л°©лІ•мңјлЎңлҠ” мҷ„м „нһҲ л°°нғҖм Ғмқё л°©мӢқмқҖ м•„лӢҲм§Җл§Ң, м–ҙл–»кІҢ condensinмқҙ м—јмғүмІҙлҘј нҳ•м„ұн•ҳлҠ”м§Җ л©”м»ӨлӢҲмҰҳмқҙ мҶҢк°ңлҗҳм–ҙ мҷ”лӢӨ. In vitroм—җм„ң condensinмқҙ DNAм—җ л¶ҷм–ҙм„ң DNAлҘј м–‘мқҳ л°©н–ҘмңјлЎң л’ӨнӢҖлҰ¬лҠ” л°ҳмқ‘мқ„ мқјмңјнӮЁлӢӨ. мқҙкІғмқҖ кҪӨ л©ҖлҰ¬ л–Ём–ҙ진 кіім—җм„ңлҸ„ condensinмқҙ DNA лЈЁн”„лҘј мқ‘축мӢңнӮ¬ мҲҳ мһҲлӢӨ. мқҙ 비нӢҖлҰјмқ„ л§Өк°ңлЎң н•ҳлҠ” кІҢлҶҲ мқ‘축 лӘЁлҚёмқҖ 비нӢҖлҰјмқ„ мӢ мҶҚнһҲ н•ҙм ңн•ҳлҸ„лЎқ м„Өкі„лҗң н’Қл¶Җн•ң topoisomeraseк°Җ к·ё мқјмқ„ н•ҳм§Җ лӘ»н•ҳлҸ„лЎқ л°©н•ҙн•ҙм•ј н•ңлӢӨ. мқҙ л¶Җ분мқҖ м•„м§Ғ л¶Ҳ분лӘ…н•ҳлӢӨ.
лҳҗ лӢӨлҘё мқёкё° мһҲлҠ” лӘЁлҚёмқҖ лЈЁн”„ лҸҢм¶ң(loop extrusion) лӘЁлҚёмқҙлӢӨ(к·ёлҰј 3b). мқҙ лӘЁлҚём—җм„ңлҠ” DNA лЈЁн”„к°Җ condensinмқ„ нҶөкіјн•ң лӢӨмқҢм—җ лҚ” л§Ғмқ„ нҶөкіјн•ҳм—¬ лЈЁн”„к°Җ нҷ•мһҘлҗңлӢӨ. Condensinмқҙ м–ҙл–»кІҢ DNA лҘј л°Җм–ҙлӮј мҲҳ мһҲлҠ” л°©лІ•м—җ лҢҖн•ң 분мһҗ л©”м»ӨлӢҲмҰҳмқҖ м•Ңл Өм§Җм§Җ м•Ҡм•ҳлӢӨ. н•ҳм§Җл§Ң, мқҙ лӘЁлҚёмқҖ м„ёк· м—јмғүмІҙ нҢ”мқ„ л”°лқј мЈјмҡ” condensin loading siteлЎңл¶Җн„° м—°мһҘлҗҳлҠ” лҢҖм№ӯ DNA м ‘мҙүмңјлЎңл¶Җн„° л’·л°ӣм№Ёмқҙ лҗңлӢӨ. н•ҳм§Җл§Ң, loop extrusionмқҖ мқҙлҹ° лҢҖм№ӯ м ‘мҙүл“Өмқ„ м„ӨлӘ…н•ҳлҠ” мң мқјн•ң л°©лІ•мқҖ м•„лӢҲлӢӨ. мқҙ лҢҖм№ӯ м ‘мҙүл“ӨмқҖ лі‘л ¬ м—јмғүмІҙ нҢ” л¶Җ분мқҳ мӮ°л°ңм Ғмқё л§ҢлӮЁмңјлЎңлҸ„ л°ңмғқлҗ мҲҳлҸ„ мһҲлӢӨ. Fission yeast м—јмғүмІҙм—җ л”°лҘё condensin нҢЁн„ҙмқҖ loading siteлЎңл¶Җн„° лӢЁл°©н–ҘмңјлЎңмқҳ нҚјм§җмқ„ м„ӨлӘ…н•ҳмҳҖлӢӨ. мқҙкІғмқҖ м–‘л°©н–Ҙмқҳ pumping кё°мһ‘мқ„ м„ӨлӘ…н•ҳм§Җ м•ҠлҠ” кІғмқҙлӢӨ. лҢҖмӢ , мқҙ нҢЁн„ҙмқҖ condensinмқҙ л‘җ к°ңмқҳ м ‘н•© л¶Җмң„лҘј мҲңм°Ём ҒмңјлЎң к°җмҢҖ л•Ң мІҳмқҢ лЈЁн”„к°Җ нҳ•м„ұлҗҳлҠ” кІғмңјлЎңлҸ„ мғқк°Ғлҗ мҲҳ мһҲлӢӨ. мқҙкІғм—җ л’Өмқҙм–ҙ, tranion-driven condensin slidingмқҖ мң м „мһҗмқҳ л°©н–Ҙм—җ л”°лқј loop expansionмңјлЎң мқҙм–ҙм§Ҳ мҲҳ мһҲлӢӨ. нҠ№нһҲ мқёк°„ condensin II ліөн•©мІҙмқҳ м—јмғүмІҙ кІ°н•©мқҖ мң мӮ¬ 분м—ҙм—җм„ң л§Өмҡ° м•Ҳм •н•ҳкІҢ лҗҳл©°, мқҙлҠ” мҲңм°Ём Ғ лЈЁн”„ нҷ•мһҘмқ„ н—Ҳмҡ©н• мҲҳ мһҲлӢӨ. к·ёлҹ¬лӮҳ мІҙм„ёнҸ¬к°Җ мң мӮ¬ 분м—ҙм—җ л“Өм–ҙк°җм—җ л”°лқј м „мӮ¬к°Җ лҢҖл¶Җ분 л©Ҳм¶”кі м „мӮ¬ мҙҲкё°м—җлҠ” м—јмғүмІҙ мқ‘축мқҙ 분лӘ…нһҲ мқјм–ҙлӮңлӢӨ. tranion-mediated loop expansionмқҙ м—јмғүмІҙ мқ‘축м—җ кё°м—¬н•ҳлҠ”м§Җ лҳҗлҠ” м—јмғүмІҙ лҸ„л©”мқё кө¬мЎ°лҘј interphaseн•ҳлҠ”м§Җ м—¬л¶ҖлҠ” 추к°Җ мЎ°мӮ¬лҘј мң„н•ң нқҘлҜёлЎңмҡҙ мЈјм ңмқҙлӢӨ.
н•ң DNA лӮҙмқҳ лЈЁн”„ extrusionм—җ мқҳн•ң м—јмғүмІҙ мқ‘축мқҳ мқҙм җмқҖ мқём ‘н•ң м—јмғүмІҙ мӮ¬мқҙмқҳ н—ӣлҗң м ‘мҙүмқ„ н”јн•ҳкё°ліҙлӢӨлҠ” мқ‘축мқҙ н•ң лІҲм—җ н•ҳлӮҳмқҳ м—јмғүмІҙлҘј 압축н•ҳлҸ„лЎқ ліҙмһҘн•ңлӢӨлҠ” кІғмһ…лӢҲлӢӨ. л°ҳл©ҙм—җ, condensin binding site мӮ¬мқҙмқҳ нҷ•лҘ м Ғмқё pairwise мғҒнҳёмһ‘мҡ©мқҖ DNA н•ң 분мһҗ лӮҙмқҳ мғҒнҳёмһ‘мҡ©мқ„ DNA л‘җ 분мһҗк°„мқҳ мғҒнҳёмһ‘мҡ©мңјлЎңл¶Җн„° мӢқлі„н• мҲҳ м—ҶлӢӨ. CondensinмқҖ мӢӨм§Ҳм ҒмңјлЎң н•ң 분мһҗ лӮҙм—җм„ңмқҳ нҠ№м • мЈјкё°м—җм„ң мғҒнҳёмһ‘мҡ©н•ҳлҠ” кІғмңјлЎң ліҙ여진лӢӨ. н•ҳм§Җл§Ң, нҷ•лҘ м Ғмқё pairwise мғҒнҳёмһ‘мҡ© мЎ°м°ЁлҸ„ м—°мҶҚм Ғмқё DNA к°ҖлӢҘмқ„ л”°лқј 분мһҗ лӮҙмқҳ м ‘мҙүм җмқ„ л‘җ м—јмғүмІҙ мӮ¬мқҙмқҳ мғҒнҳёмһ‘мҡ©ліҙлӢӨ н•ӯмғҒ м„ нҳён•ңлӢӨ. condensinмқҙ л§Өк°ңн•ҳлҠ” мғҒнҳёмһ‘мҡ©мқҙ мқ‘축 кіјм • лҸҷм•Ҳ лҸҷл Ҙмқ„ мң м§Җн•ҳлҠ” н•ҳл©ҙм„ң, лӘЁл“ interchromosomal contactк°Җ мқјмӢңм ҒмңјлЎң лӮЁм•„м„ң н•ҙкІ°лҗҳлҠ” лҸҷм•Ҳ, мқҙкІғмқҖ м—јмғүмІҙмқҳ к°ңлі„нҷ”к°Җ мқҙлӨ„м§ҖкІҢ н•ңлӢӨ.
6.2 м—јмғүмІҙ Resolution
Condensinмқҳ кІ°н•Ёмқҙ мғқкёё л•Ң мһҗл§Өм—јмғү분мІҙк°Җ мң мӮ¬л¶„м—ҙ нӣ„кё°м—җм„ң 분лҰ¬лҗң лӘЁмҠөмқҙ м•Ҳ ліҙмқҙкІҢ лҗңлӢӨ. мқҙкІғмқ„ м—јмғүмІҙ лӢӨлҰ¬(chromosome bridge)лқјкі н•ңлӢӨ. мқҙ нӣ„кё°м—җм„ң мқјм–ҙлӮҳлҠ” м—јмғүмІҙ лӢӨлҰ¬лҠ” л”ё м—јмғү분мІҙ кІ°н•©мқ„ кі„мҶҚн•ҳкІҢ л§Ңл“ңлҠ” кІғ л•Ңл¬ём—җ мғқкё°кІҢ лҗңлӢӨ. DNA ліөм ңмқҳ мў…кІ°лҗҳлҠ” лҸҷм•Ҳ, replication forkм—җм„ң Topoisomeraseмқҳ л¶Ҳнҷңм„ұмңјлЎң мһҗл§Өм—јмғү분мІҙлҠ” н•„м—°м ҒмңјлЎң кі„мҶҚн•ҙм„ң catenation(м—°кІ°)лҗңлӢӨ. DNA ліөм ң мў…кІ° мқҙнӣ„м—җ м–ҙл””м„ң, м–јл§ҲлӮҳ м—°кІ°мқҙ м§ҖмҶҚлҗҳм–ҙ мһҲлҠ”м§ҖлҠ” м•Ңл Ө진 кІғмқҙ м—ҶлӢӨ. мӣҗнҳ• лҜёлӢҲ м—јмғүмІҙлҘј мқҙмҡ©н•ҳм—¬, DNA ліөм ң мқҙнӣ„м—җ лҢҖл¶Җ분мқҳ DNA catenationмқҖ мһ¬л№ лҘҙкІҢ м—Ҷм–ҙм§ҖлҠ” кІғ к°ҷлӢӨ. л°ҳл©ҙ м–ҙлҠҗ м •лҸ„лҠ” мң„мғҒм Ғмқё м—°кІ°мқҙ м§ҖмҶҚлҗҳкі , мқҙ resolutionмқ„ мң„н•ҙ condensinм—җ мқҳмЎҙлҗңлӢӨ. м—јмғүмІҙ мқ‘축мӢң, м—јмғүмІҙ нҢ” к°ңлі„нҷ”лҠ” DNA decatenation кіјм •мқҳ л°©н–Ҙм„ұмқ„ м ңкіөн•ңлӢӨ. к·ёлҹ¬лӮҳ мқҙлЎң DNA decatenationмқ„ мң„н•ң condensinмқҳ м—ӯн• мқ„ лӢӨ м„ӨлӘ…н• мҲҳлҠ” м—ҶлӢӨ. Budding yeastмқҳ rDNA segregationмқ„ мң„н•ң condensinмқҳ н•„мҡ”лҠ” мҷёл¶Җ topoisomerase IIлҘј л°ңнҳ„мӢңнӮҙмңјлЎң к·№ліөлҗңлӢӨ. н•ҳм§Җл§Ң, endogeneous topoisomerase IIлҘј кіјлӢӨ л°ңнҳ„ мӢңмј°мқ„ л•ҢлҠ” к·№ліөмқҙ лҗҳм§Җ м•Ҡм•ҳлӢӨ. мқҙлҠ” endogeneous topoisomerase IIлҠ” м•„мЈј к°•н•ң condensinм—җ лҢҖн•ң мқҳмЎҙм„ұмқ„ ліҙм—¬мЈјлҠ” кІғмқҙлӢӨ. л°•н…ҢлҰ¬м•„ decatenationн•ҳлҠ” topoisomerase IVмҷҖ л°•н…ҢлҰ¬м•„ SMC ліөн•©мІҙмқҳ м§Ғм ‘ мғҒнҳёмһ‘мҡ©мқҙ кҙҖм°°мқҙ лҗҳм—Ҳкі , мқҙкІғмқҖ мқҙ л‘җ нҡЁмҶҢ мӮ¬мқҙмқҳ нҳ‘лҸҷ мһ‘мҡ©мқ„ мқҙн•ҙн•ҳлҠ”лҚ° лҸ„мӣҖмқ„ мЈјм—ҲлӢӨ. к·ёлҹ¬лӮҳ, м•„м§Ғ 진н•өмғқл¬јм—җм„ңлҠ” мқҙлҹ° мғҒнҳёмһ‘мҡ©мқҙ л°ңкІ¬мқҙ лҗҳм§Җ м•Ҡм•„м„ң, м–ҙл–»кІҢ м—јмғүмІҙ resolutionмқ„ condensinмқҙ мқјмңјнӮӨлҠ”м§ҖлҠ” м•„м§ҒлҸ„ мқҳл¬ёмқҙлӢӨ. Condeinsinмқҳ нҷңм„ұмқҙ мң„мғҒм Ғмқё м ‘мҙүмқ„ л„ҳм–ҙм„ңм„ң м—¬кё°м—җ мһ‘лҸҷлҗ кІғмқҙлқјкі л§Ң м¶”мёЎн• л”°лҰ„мқҙлӢӨ.
7. Cohesin л°Ҹ cohesion establishment
G1 phaseм—җм„ңлҠ” мқёк°„ cohesinмқҖ condensingкіј 비мҠ·н•ҳкІҢ мһ‘мҡ©н•ңлӢӨ. мқём ‘н•ң л¶Җм°© л¶Җ분л“Ө мӮ¬мқҙлҘј л§һл¬јлҰ¬кІҢ н•ңлӢӨ. мқҙ кІ°н•©мқҖ м•„мЈј лҸҷм ҒмқҙлӢӨ. Wapl м„ңлёҢмң лӢӣмқҙ мқҙ ліөн•©мІҙмқҳ unloadingкіј reloading мӮ¬мқҙнҒҙмқ„ мҙү진мӢңнӮЁлӢӨ. Waplмқҙ м—ҶлҠ” кІҪмҡ°м—җлҠ” cohesinмқҙ м—јмғүмІҙм—җ л¶ҷкі л–Ём–ҙм§ҖлҠ” мҶҚлҸ„к°Җ лҠҗл Ө진лӢӨ. к·ёлҰ¬кі condensinкіј к°ҷмқҖ м–‘мғҒмқҙ лҚ” мҰқлҢҖлҗңлӢӨ. мқҙкІғмқҖ лІ„лҜёмІјлҰ¬лқјкі л¶ҲлҰ¬лҠ” лІҢл Ҳ лӘЁм–‘мқҳ м—јмғүмІҙмқҳ м„ёнҸ¬н•ҷм Ғмқё лӘЁм–‘мқ„ л§Ңл“Өм–ҙлӮёлӢӨ. к·ё cohesinмқҖ мң мӮ¬л¶„м—ҙмӢңкё° м—јмғүмІҙ мқ‘축м—җ кіөн—Ңмқ„ н•ҳкі , Waplм—җ мқҳн•ҙ м •көҗн•ҳкІҢ мЎ°мңЁмқҙ лҗңлӢӨ. мқҙкІғмқҖ S. cerevisiae м—җм„ңлҸ„ м•Ңл ӨмЎҢлӢӨ.
Cohesinмқҙ condensinкіј лӢӨлҘё кІғмқҖ м—јмғү분мІҙ кІ°н•©мқ„ S phase лҸҷм•Ҳм—җ м§ҖмҶҚмӢңнӮӨлҠ” cohesinмқҳ мң мқјн•ң лҠҘл ҘмқҙлӢӨ. мқҙ кіјм •мқҖ Smc3 ATPase headм—җ мһҲлҠ” Lys л Ҳм§Җл“Җл“Өмқҳ м•„м„ёнӢёнҷ”к°Җ н•„мҡ”н•ҳлӢӨ. к·ё м•„м„ёнӢёнҷ”лҠ” replication forkк°Җ кІ°н•©лҗң Eco1 (Estabilishment of cohesion 1) м•„м„ёнӢёнҡЁмҶҢм—җ мқҳн•ҙ мқјм–ҙлӮңлӢӨ. мқҙкІҢ DNAм—җ лЎңл”©мқҙ лҗң лӢӨмқҢм—җлҠ” cohesin ATPaseлҠ” нҷңм„ұнҷ”лҗң мұ„лЎң мһҲлӢӨ. мқҙкІғмқҖ мҷ„м „н•ң лҸҷм Ғмқё DNA кІ°н•©кіј 분м—ҙ мӮ¬мқҙнҒҙкіј кІҪмҹҒмқ„ н•ңлӢӨ. м•„м„ёнӢёнҷ”лҠ” DNAк°Җ ATP к°ҖмҲҳ분н•ҙлҘј м•јкё°н•ҳлҠ” кІғмқ„ л§үкІҢ н•ЁмңјлЎң cohesin л§Ғмқ„ мһ к·јлӢӨ. мқҙкІғмқҖ мқҙкІғмқҖ м–ҙл–»кІҢ DNA ліөм ң лҸҷм•Ҳ cohesinмқҙ DNA м•Ҳм •н•ҳкІҢ л¶ҷм–ҙ мһҲлҠ”м§ҖмҷҖ м§ҖмҶҚм Ғмқё мһҗл§Өм—јмғү분мІҙ кІ°н•©мқҙ мқҙлӨ„м§ҖлҠ”м§Җм—җ лҢҖн•ң к·јкұ°лҘј м ңмӢңн•ңлӢӨ. нҠ№лі„нһҲ, DNAлҘј м„јмӢұн•ҳлҠ” Lys л Ҳм§Җл“ҖлҠ” DNA entryлҘј мң„н•ҙ 비мҠ·н•ҳкІҢ н•„мҡ”н•ҳлӢӨ. мқҙлҠ” Smc3 м•„м„ёнӢёнҷ”к°Җ м—„кІ©н•ң мӢңк°„, кіөк°„ мЎ°м Ҳ н•ҳм—җм„ң мқјм–ҙлӮҳм•јн•Ёмқ„ мқҳлҜён•ңлӢӨ. мқҙ м•„м„ёнӢёнҷ”лҠ” л‘җ мһҗл§Өм—јмғү분мІҙлҘј к°Җл‘җкё° мң„н•ҙ н•„мҡ”н•ң лӘЁл“ ATP к°ҖмҲҳ분н•ҙ мқҳмЎҙ DNA entry л°ҳмқ‘мқ„ л§Ҳл¬ҙлҰ¬н•ҳлҠ” кІғмқ„ кё°лӢӨл Өм•ј н•ңлӢӨ. н•ҳм§Җл§Ң, к·ё лӢӨмқҢм—җлҠ” н•ң мһҗл§Ө분мІҙк°Җ л§Ғ л°–мңјлЎң лӮҳк°ҖлҠ” м°¬мҠӨлҘј к°Җм§Җкё° м „м—җ л°ҳл“ңмӢң мөңлҢҖн•ң л№ЁлҰ¬ м•„м„ёнӢёнҷ”к°Җ мқјм–ҙлӮҳм•ј н•ңлӢӨ.
л‘җ к°ңмқҳ мһҗл§Ө DNA к°ҖлӢҘл“Өмқ„ н•ң cohesin л§Ғм—җ к°Җл‘җлҠ” л‘җ к°ңмқҳ мғҒнҳё л°°нғҖм Ғмқё л°©лІ•мқ„ мғҒмғҒн•ҙ ліј мҲҳ мһҲлӢӨ. н•ң к°ҖлҠҘм„ұмқҖ replication forkк°Җ cohesin ringмқ„ м§ҖлӮҳк°ҖлҠ” кІғмқҙлӢӨ. мқҙкІғмқҖ ліөм ң мӮ°л¬јмқ„ мһЎкё°м—җ нҡЁмңЁм Ғмқј кІғмқҙлӢӨ. мқҙ кІҪмҡ°м—җлҠ” м–ҙл–Ө мӢңк°„м—җм„ңл“ forkлҘј м§ҖлӮҳк°Җкё° м „ лҳҗлҠ” м§ҖлӮҳк°ҖлҠ” лҸ„мӨ‘м—җ м•„м„ёнӢёнҷ”к°Җ м—јмғү분мІҙ кІ°н•©мқ„ л§Ңл“ лӢӨ. л”°лқјм„ң кІ°н•©мқҙ 진н–үлҗҳлҠ” лҸҷм•Ҳ лӢӨлҘё мғҲлЎңмҡҙ DNA entry л°ҳмқ‘мқҙ н•„мҡ”н•ҳм§Җ м•ҠлӢӨ. мһҗл§Өм—јмғү분мІҙ кІ°н•©мқҙ DNA entryмқҳ мҶҚлҸ„лҘј лҠҰ추лҠ” cohesin ATPase лҸҢм—°ліҖмқҙм—җ к·ёлҰ¬ мҳҲлҜјн•ҳкІҢ л°ҳмқ‘н•ҳм§Җ м•ҠлҠ”лӢӨлҠ” мӮ¬мӢӨкіј Scc2-Scc4 cohesinк°Җ DNA ліөм ңн•ҳлҠ” лҸҷм•Ҳ лҚ” мқҙмғҒ н•„мҲҳм Ғмқҙм§Җ м•ҠлӢӨлҠ” кІғмқҖ мқҙ к°ҖлҠҘм„ұкіј мқјм№ҳн•ңлӢӨ.
л°ҳлҢҖлЎң, л§Ңм•Ҫ replication forkк°Җ cohesin л§Ғмқ„ нҶөкіјн•ҳм§Җ лӘ»н•ҳл©ҙ, condensin 비мҠ·н•ң кІҪн–Ҙмқҳ cohesinмқҙ DNA 분мһҗмқҳ к·јм ‘н•ң кіілҒјлҰ¬ л§ҒнҒ¬лҘј л§Ңл“Ө мҲҳ мһҲлӢӨ. мӮ¬мӢӨ, budding yeast condensinмқҖ л‘җ мһҗл§Өм—јмғү분мІҙмқҳ мғҒнҳёмһ‘мҡ©мқ„ н• мҲҳ мһҲкІҢ н•ңлӢӨ. к·ёлҹ¬лӮҳ мқҙкІғмқҖ м•„л§Ҳ м•„мЈј лҸҷм Ғмқҙл©°, м•Ҳм •м Ғмқё мһҗл§Өм—јмғү분мІҙ кІ°н•©мқ„ м ңкіөн• мҲҳ м—Ҷмқ„ кІғмқҙлӢӨ. мһҗл§Ө м—јмғү분мІҙл“ӨмқҖ replication forkм—җм„ңл¶Җн„° лӮҳмҷ”кё° л•Ңл¬ём—җ м„ңлЎң к°Җк№қкё° л•Ңл¬ём—җ cohesin лҳҗлҠ” condensinмқҙ л‘җ м—јмғү분мІҙлҘј н•Ёк»ҳ нҸ¬м°©н• мҲҳ мһҲлҠ” мўӢмқҖ кё°нҡҢлҘј м ңкіөн• кІғмқҙлӢӨ. мқҙ кІҪмҡ°м—җлҠ”, cohesin м•„м„ёнӢёнҷ”к°Җ л‘җ мһҗл§Ө분мІҙк°Җ cohesin ringм—җ л§ү л“Өм–ҙк°”мқ„ л•Ң мқјм–ҙлӮҳм„ң н•ң мҢҚмқҳ ліөм ң мғқм„ұл¬јмқҙ к·ё м•Ҳм—җ кі м •лҗҳлҠ” кІғмқҙ мӨ‘мҡ”н•ҳлӢӨ. ESCO1м—җ мқҳн•ң мқёк°„ SMC3 м•„м„ёнӢёнҷ”к°Җ ATP к°ҖмҲҳ 분н•ҙмҷҖ м—°кҙҖлҗҳм–ҙ мһҲлӢӨлҠ” кҙҖм°°мқҖ мқҙкІғмқ„ лӢ¬м„ұн•ҳлҠ” л©”м»ӨлӢҲмҰҳмқҳ мқјл¶Җмқј мҲҳ мһҲлӢӨ. мқҙ мӢңлӮҳлҰ¬мҳӨм—җм„ңлҠ”, cohesinмқҙ мһ кёё мҲҳ мһҲлҠ” condensinмңјлЎң мғқк°Ғн• мҲҳ мһҲлҠ”лҚ°, мқҙкІғмқҖ л‘җ мһҗл§Өм—јмғү분мІҙ кІ°н•©мқ„ replication fork л’Өм—җм„ң ліөм ң мӮ°л¬јмқ„ нҷ•лҘ м Ғмқё лҸҷмӢң нҸ¬м°©н•ҳм—¬ мҷ„м„ұн• мҲҳ мһҲлӢӨ.
мң„мқҳ л‘җ мӢңлӮҳлҰ¬мҳӨ лӘЁл‘җ м—јмғү분мІҙ кІ°н•© нҳ•м„ұм—җ мӨ‘ліөмңјлЎң кё°м—¬н• к°ҖлҠҘм„ұмқҖ мқёк°„ Eco1мқҳ paralogueмқё ESCO1кіј ESCO2 분м„қм—җ мқҳн•ҙ л’·л°ӣм№Ё лҗңлӢӨ. л‘җ нҡЁмҶҢ лӘЁл‘җ лҸҷл“ұн•ң мЎ°кұҙм—җм„ң мһҗл§Өм—јмғү분мІҙ кІ°н•©м—җ кё°м—¬н•ңлӢӨ. ESCO1мқҖ м„ёнҸ¬мЈјкё°лҘј нҶөн•ҙ cohesinкіј м§Ғм ‘ мғҒнҳёмһ‘мҡ©н•ҳкі DNA ліөм ңмҷҖ лҸ…лҰҪм ҒмңјлЎң G1мІҳлҹј мҙҲкё° cohesinмқ„ м•„м„ёнӢёнҷ”н•ңлӢӨ. мқјлӢЁ cohesinмқҙ м•„м„ёнӢёнҷ”лҗң нӣ„м—җ лҚ” мқҙмғҒ мғҲлЎңмҡҙ DNA к°ҖлӢҘмқ„ м°Ём§Җн•ҳм§Җ м•Ҡмңјл©ҙ G1м—җм„ң м•„м„ёнӢёнҷ”лҗң cohesinмқҙ мһҗл§Өм—јмғү분мІҙ мқ‘집м—җ кё°м—¬н•ҳлҠ” мң мқјн•ң л°©лІ•мқҖ кі лҰ¬лҘј нҶөн•ң ліөм ң 분기 нҶөкіјмқҙлӢӨ. к·ёлҹ¬лӮҳ ESCO2лҠ” ліөм ң нҸ¬нҒ¬ л°”лЎң л’Өм—җ мһҲлҠ” н–үлҸҷ л°©мӢқкіј мқјм№ҳн•ҳлҠ” мһҗл§Өм—јмғүмІҙ кІ°н•©мқ„ мқҙлЈЁкё° мң„н•ҙ ліөм ң лӢЁл°ұм§Ҳмқ„ мҰқмӢқмӢңнӮӨлҠ” м„ёнҸ¬ н•ө н•ӯмӣҗ(PCNA)кіј мғҒнҳё мһ‘мҡ©н•ңлӢӨ. Budding yeastм—җм„ңлҠ” Eco1мқҳ к°•л Ҙн•ң кіјл°ңнҳ„мңјлЎңлҸ„ ліөм ң нҸ¬нҒ¬ 진н–үкіј л°Җм ‘н•ң кҙҖкі„к°Җ мһҲлҠ” мқ‘집 м•„м„ёнӢёнҷ”лҘј 진н–үмӢңнӮ¬ мҲҳ м—ҶлӢӨ. Cohesin м•„м„ёнӢёнҷ”м—җ лҢҖн•ң мӢңкіөк°„м Ғ м ңм–ҙмқҳ кё°мҙҲк°Җ лҗҳлҠ” л©”м»ӨлӢҲмҰҳмқҖ лҚ” м—°кө¬лҘј н•ҙм•ј н•ңлӢӨ.
Budding yeast Smc3 м•„м„ёнӢёнҷ”к°Җ DNA ліөм ң мӨ‘м—җл§Ң мқјм–ҙлӮҳлҠ” лӘЁлҚёмқҖ S лӢЁкі„ нӣ„м—җ мһҗл§Өм—јмғү분мІҙ кІ°н•© нҳ•м„ұмқҙ к°ҖлҠҘн•ҙм§ҖлҠ” мғҒнҷ©кіјлҠ” лӘЁмҲңмқҙ лҗңлӢӨ. DNA мҶҗмғҒм—җ лҢҖн•ң л°ҳмқ‘мңјлЎң, G2/M м„ёнҸ¬мқҳ мҡ©н•ҙлҗң cohesinмқҖ кё°мЎҙмқҳ м—°кІ° кі лҰ¬лҘј к°•нҷ”н•ҳм—¬ мғҲлЎңмҡҙ мһҗл§Өм—јмғү분мІҙ кІ°н•©мІҙлҘј нҳ•м„ұн•ңлӢӨ. Eco1мқҳ кіјл°ңнҳ„ лҳҗлҠ” G2/M мӢңкё°мқҳ Eco1 мҲҳмӨҖмқ„ к°җмҶҢмӢңнӮӨлҠ” Eco1м—җ лҢҖн•ң Cdk phosphodegronмқҳ нҢҢкҙҙлҠ” мқҙ мӢңм җм—җм„ң 추к°Җм Ғмқё кІ°н•© нҳ•м„ұмқ„ н—Ҳмҡ©н•ҳкё°м—җ 충분н•ҳлӢӨ. DNA мҶҗмғҒ л°ҳмқ‘ кІҪлЎңк°Җ мқ‘집 нҳ•м„ұм—җ кё°м—¬н•ҳлҠ” л°©лІ•кіј Smc3 мқҙмҷёмқҳ cohesin мҶҢлӢЁмң„(м•„л§ҲлҸ„ Scc1)к°Җ мқҙлҹ¬н•ң мЎ°кұҙм—җм„ң м•„м„ёнӢёнҷ” мҲҳмҡ©мІҙмқём§Җ м—¬л¶ҖлҠ” м•„м§Ғ мӨ‘мҡ”н•ң м§Ҳл¬ёмқҙлӢӨ.
мІҷ추 лҸҷл¬јм—җм„ң S лӢЁкі„мқҳ SMC3 м•„м„ёнӢёнҷ”лҠ” 추к°Җм Ғмқё н•„мҲҳ cohesin ліөн•©мІҙ м„ұ분мқё sororinмқ„ лҒҢм–ҙмҳӨл Өкі мң лҸ„н•ҳл©°, sororinмқҖ PDS5м—җ кІ°н•©н•ҳкё° мң„н•ҙ WAPLкіј кІҪмҹҒн•ңлӢӨ. SMC3 м•„м„ёнӢёнҷ”лҠ” sororin лҸҷмӣҗм—җ н•„мҡ”н•ҳм§Җл§Ң S мӢңкё°м—җ м•„м„ёнӢёнҷ”к°Җ мҷёл¶Җм—җм„ң л°ңмғқн•ҳлҠ” кІҪмҡ°м—җлҠ” sororinмқ„ лҒҢм–ҙ лӢ№кё°м§Җ м•ҠлҠ”лӢӨ. S мӢңкё°м—җм„ң м–»мқҖ sororin лҸ„нӮ№ л¶Җмң„мқҳ 분мһҗ м„ұм§Ҳмқҙ мӨ‘мҡ”н•ҳлӢӨ. н•ҳлӮҳмқҳ к°ҖлҠҘм„ұмқҖ replisomeмқҳ л§ҘлқҪм—җм„ң ESCO2к°Җ л‘җ DNA к°җк°Ғ Lys мһ”кё° мқҙмҷём—җ cohesin мһ”кё°лҘј м•„м„ёнӢёнҷ”мӢңнӮӨлҠ” кІғмқҙлӢӨ.
мІҷ추 лҸҷл¬јм—җм„ң л°ңмғқн•ҳлҠ” лҳҗ лӢӨлҘё мҲҳмҲҳк»ҳлҒјлҠ” м„ёнҸ¬к°Җ мң мӮ¬ 분м—ҙм—җ л“Өм–ҙк°җм—җ л”°лқј м—јмғүмІҙм—җм„ң cohesinмқ„ м ңкұ°н•ҳлҠ” кІғкіј кҙҖл Ёмқҙ мһҲлӢӨ. cohesinмқҳ мғҒлӢ№ л¶Җ분мқҙ м„ёнҸ¬к°Җ мң мӮ¬л¶„м—ҙлЎң л“Өм–ҙк°Җкё° м „м—җ м—јмғүмІҙм—җм„ң м ңкұ°н•ңлӢӨлҠ” кІғмқҖ м „кё° кІҪлЎңлЎң м•Ңл Өм ё мһҲлӢӨ. мқҙкІғмқҖ 분лҰ¬ нҡЁмҶҢ(separase) м ҲлӢЁмқҙ н•„мҡ”н•ҳм§Җ м•Ҡм§Җл§Ң sororinмқ„ мқёмӮ°нҷ”мӢңмјң cohesinкіјмқҳ мғҒнҳё мһ‘мҡ©мқ„ л¶Ҳм•Ҳм •н•ҳкІҢ н•ҳлҠ” мң мӮ¬ 분м—ҙ kinaseм—җ мқҳн•ҙ мҙү진лҗңлӢӨ. WAPLмқҖ cohesin unloadingмқ„ мҙү진мӢңнӮЁлӢӨ. cohesinмқҳ prophaseм—җм„ң м—Ҷм–ҙм§ҖлҠ” кІғмқҖ м„ұкіөм Ғмқё мң мӮ¬л¶„м—ҙмқ„ мң„н•ҙ мӨ‘мҡ”н•ҳлӢӨ. WAPLмқҙ кІ°м—¬лҗң м„ёнҸ¬м—җм„ң м—јмғүмІҙ 분лҰ¬ мӢӨнҢЁк°Җ кҙҖм°°мқҙ лҗҳм—ҲлӢӨ. мқҙлҠ” м•„л§ҲлҸ„, мҙҲкё° cohesin м ңкұ°к°Җ DNA catenationмқҳ resolutionмқ„ мҙү진мӢңнӮ¬ кІғмқҙкё° л•Ңл¬ёмқҙлӢӨ. Cohesinмқҙ м•„м„ёнӢёнҷ”лҗң мғҒнғңмқҳ м „мқҙ кІҪлЎңм—җ мқҳн•ҙ м—јмғүмІҙм—җм„ң л°©м¶ңлҗҳлҠ” кІғмңјлЎң м ңм•Ҳлҗҳм—ҲлӢӨ. мқҙкІғмқҖ м•„м„ёнӢёнҷ”к°Җ мқёк°„ м„ёнҸ¬м—җм„ң cohesinмқ„ м•Ҳм •нҷ”мӢңнӮӨкё°м—җ л¶Ҳ충분함мқ„ лӮҳнғҖлӮёлӢӨ. мқёк°„ м„ёнҸ¬мқҳ м„ёнҸ¬мЈјкё°к°Җ budding yeastмқҳ м„ёнҸ¬мЈјкё°ліҙлӢӨ 10л°° мқҙмғҒ нҒ¬кё°ліҙлӢӨлҸ„ кёёкё° л•Ңл¬ём—җ м•„м„ёнӢёнҷ”м—җ мқҳн•ҙ нҸҗмҮ„лҗҳлҠ” ATPase head gateмҷҖ sororinмқҳ мЎ°м Ҳн•ҳм—җ мһҲлҠ” SMC3-kleisin gateлҠ” м—јмғүмІҙм—җ мқ‘집мқ„ нҷ•ліҙн•ҳкё° мң„н•ҙ мһ кІЁмһҲм–ҙм•ј н•ңлӢӨ. м „ мҙҲкё° лӢЁкі„м—җм„ң centromeresмқҳ sororinмқҖ shugoshin-PP2A phosphatase complexм—җ мқҳн•ҙ мң мӮ¬ 분м—ҙ kinaseлЎңл¶Җн„° ліҙнҳёлҗҳм–ҙ 분лҰ¬ нҡЁмҶҢк°Җ нҷңм„ұнҷ”лҗҳм–ҙ cohesinмқ„ 분н•ҙн•ҳкі нӣ„кё°лҘј мң л°ңн• л•Ңк№Ңм§Җ мҳҒм—ӯмқҳ мһҗл§Өм—јмғү분мІҙ кІ°н•©мқ„ ліҙмЎҙн•ңлӢӨ.
8. кІҢлҶҲ м•Ҳм •м„ұ(genome stability)м—җм„ңмқҳ SMC ліөн•©мІҙ
Smc5-Smc6 ліөн•©мІҙлҠ” лӘЁл“ 진н•өмғқл¬јм—җм„ң м ң 3мқҳ н•„мҲҳм Ғмқё SMC ліөн•©мІҙлҘј нҳ•м„ұн•ңлӢӨ. мқҙкІғмқҖ мһ¬мЎ°н•©м—җ мқҳн•ң DNA ліөкө¬м—җм„ң мӨ‘мҡ”н•ң л¶Җ분мқ„ лӢҙлӢ№н•ҳлҠ”лҚ°, мһ¬мЎ°н•© мӨ‘к°„мІҙмқҳ 분н•ҙлҘј мҙү진н•ңлӢӨ. к·ёлҹ¬лӮҳ лӢӨлҘё мһ¬мЎ°н•© лӢЁл°ұм§ҲмқҖ лӢЁмҲңн•ң 진н•өмғқл¬јмқҳ мғқмЎҙм—җ н•„мҲҳм ҒмқҙлҜҖлЎң ліөн•©мІҙмқҳ м§„м •н•ң ліём§Ҳм Ғмқё кё°лҠҘмқҖ м•„м§Ғ мқҙн•ҙк°Җ м•Ҳлҗҳм—ҲлӢӨ. мөңк·јмқҳ м—°кө¬лҠ” G2лӮҳ мң мӮ¬ 분м—ҙм—җм„ңмқҳ мқҙ лӢЁл°ұм§Ҳ ліөн•©мІҙмқҳ н•„мҲҳм Ғмқё м—ӯн• мқ„ 축мҶҢмӢңмј°лӢӨ. н•ҳлӮҳмқҳ м•„мқҙл””м–ҙлҠ” Smc5-Smc6 ліөн•©мІҙк°Җ м—Ҷмңјл©ҙ мһ¬мЎ°н•©м—җ мқҳн•ң нӣ„мҶҚм Ғмқё мҲҳлҰ¬лҘј н•„мҡ”лЎң н•ҳлҠ” нӣ„кё° ліөм ң лҸҷм•Ҳ DNA lesionмқ„ м•јкё°н•ңлӢӨлҠ” кІғмқҙлӢӨ. DNA мң„мғҒкіј кҙҖл Ёлҗң м—ӯн• мқҖ лҳҗ лӢӨлҘё мӢӨл§ҲлҰ¬к°Җ лҗ кІғмқҙлӢӨ.
Smc5-Smc6 ліөн•©мІҙ мҷём—җлҸ„ cohesinкіј condensinмқҖ DNA lesionм—җлҸ„ л°ҳмқ‘н•ңлӢӨ. Cohesinкіј Smc5-Smc6мқҖ DNA мҶҗмғҒ л°ҳмқ‘мқҳ мқјл¶ҖлЎң мқҙмӨ‘ к°ҖлӢҘ DNA м ҲлӢЁ л¶Җмң„м—җ 축м ҒлҗңлӢӨ. CohesinмқҖ homologous recombinationм—җ мқҳн•ң мҲҳм„ мқ„ мҡ©мқҙн•ҳкІҢ н•ҳкё° мң„н•ҙ DNA мҶҗмғҒ л¶Җмң„ мЈјмң„м—җ мһҗл§Өм—јмғү분мІҙ кІ°н•©л Ҙмқ„ к°•нҷ”мӢңнӮЁлӢӨ. кё°мЎҙм—җ мһҲлҠ” cohesin кІ°н•© л¶Җмң„ к·јмІҳм—җм„ң DNA мҶҗмғҒмқҙ мқјм–ҙлӮҳлҠ”м§Җ м•Ҳмқјм–ҙлӮҳлҠ”м§Җм—җ л”°лқј DNA мҶҗмғҒ ліөмӣҗмқҳ кІ°кіјк°Җ мҳҒн–Ҙмқ„ л°ӣлҠ”м§Җ м—¬л¶ҖлҠ” нқҘлҜёлЎңмҡё кІғмқҙлӢӨ. лҳҗн•ң, cohesinмқҖ к·ё к·јм ‘м„ұмқ„ мң м§Җн•ҳкё° мң„н•ҙ лҒҠм–ҙ진 л§җлӢЁ мӮ¬мқҙмқҳ л§ҒнҒ¬лҘј м„Өм •н• мҲҳ мһҲлӢӨ. н•өм—җм„ң м—јмғүм§Ҳмқҳ л№ лҘё мӣҖм§Ғмһ„мқ„ кі л Өн• л•Ң, мҶҗмғҒлҗң DNAмқҳ cohesinм—җ мқҳн•ң л§җлӢЁл“Өмқҳ кі м •нҷ”к°Җ лҗҳлҠ” кІғмқҙ DNA ліөкө¬лҘј мң„н•ҙ м•„мЈј мӨ‘мҡ”н•ҳлӢӨ.
CondensinмқҖ лӢӨмӢң Smc5-Smc6 ліөн•©мІҙмҷҖ н•Ёк»ҳ нҡЁлӘЁм—җм„ң м •м§Җлҗң DNA ліөм ң нҸ¬нҒ¬м—җ 축м ҒлҗңлӢӨ. CondensinмқҖ ліөм ң мҠӨнҠёл ҲмҠӨ мқҙнӣ„ мқёмІҙ м„ёнҸ¬м—җм„ң кө¬мЎ°м Ғ м—јмғүмІҙ мҷ„м „н•Ёмқ„ мң м§Җн•ҳкі лҳҗн•ң 분м—ҙ нҡЁлӘЁм—җм„ң мһҗмҷём„ мҶҗмғҒ ліөкө¬м—җ кё°м—¬н•ңлӢӨ. DNA лӢЁм ҲмӢң cohesinкіј мң мӮ¬н•ҳкІҢ condensinмқҖ м •м§Җлҗң ліөм ң нҸ¬нҒ¬лҘј м•Ҳм •нҷ”мӢңнӮ¬ мҲҳ мһҲлӢӨ. н•ҳлӮҳмқҳ к°ҖлӢҘмқҙ нҢҢмҶҗлҗҳм–ҙ н‘ңлҘҳн•ҳлҠ” кІҪмҡ° ліөм ң мһ¬мӢңмһ‘мқҙ нӣЁм”¬ м–ҙл Өмҡё мҲҳ мһҲлӢӨ. SMCлҠ” DNAк°Җ лҒҠм–ҙм§Җкұ°лӮҳ нҸ¬нҒ¬к°Җ л©Ҳ추лҠ” кіім—җм„ң мһ‘мҡ©лҗҳм–ҙм„ң, л¶Җм„ң진 лјҲ мЈјмң„м—җ л°ңлқјм§„ к№ҒмҠӨ к°ҷмқҙ л¶Җм„ңм§Җкё° мү¬мҡҙ кө¬мЎ°лҘј м•Ҳм •нҷ”мӢңнӮ¬ мҲҳ мһҲлӢӨ.
9. кІ°лЎ
SMC ліөн•©мІҙл“Өмқҳ defectл“ӨмқҖ м§Ҳлі‘мқ„ мқјмңјнӮ¬ мҲҳ мһҲлӢӨ. м•һмңјлЎң н•ҙкІ°н•ҙм•ј н•ҳлҠ” мӨ‘мҡ”н•ң м§Ҳл¬ёл“ӨмқҖ м–ҙл–»кІҢ н•ң мЎ°к°Ғ мқҙмғҒмқҳ DNAмҷҖ мқҙ лӢЁл°ұм§Ҳл“Өмқҙ interactionмқ„ н• мҲҳ мһҲлҠ”м§Җ, м–ҙл–»кІҢ мқҙл“Өмқҳ interactionмқҙ мқёк°„ м—јмғүмІҙ нҳ•мғҒмқ„ л§Ңл“Өм–ҙлӮҙлҠ”м§Җ мқҙлӢӨ. кі н•ҙмғҒлҸ„ кө¬мЎ° кҙҖм°°кіј мқҙл“Өмқҳ м–‘мғҒмқ„ лӢЁл¶„мһҗ л ҲлІЁм—җм„ң кҙҖм°°н•Ёкіј лҸҷмӢңм—җ мғқнҷ”н•ҷ, мң м „н•ҷ, кІҢлҶҲ м ‘к·јлІ•л“ӨмқҖ м•һмңјлЎң м–ҙл–»кІҢ м—јмғүмІҙк°Җ нҳ•мғҒнҷ” лҗҳлҠ”м§Җ м–ҙл–»кІҢ м—јмғүмІҙк°Җ мҡ°лҰ¬мқҳ кұҙк°•мқ„ мң м§Җн•ҳкІҢ н•ҳлҠ”м§ҖлҘј л°қнҳҖлӮҙлҠ”лҚ° кё°м—¬н•ҳкІҢ лҗ кІғмқҙлӢӨ.
м¶ңмІҳ : мғқл¬јн•ҷм—°кө¬м •ліҙм„јн„°(BRIC) (л°”лЎңк°Җкё°)
|
IP : 192.168.31.*** 
![[BRIC] SMC ліөн•©мІҙ: DNAм—җм„ң м—јмғүмІҙк№Ңм§Җ кІҢмӢңл¬јлЎң л°”лЎңк°Җкё°,QRмҪ”л“ң https://yesme.kiom.re.kr/Trend/articles/view/tableid/tech/id/1341](/attach/qrcode/board_1341.png)
|
| лІҲнҳё | нҢҢмқј | м ңлӘ© | мқҙлҰ„ | мһ‘м„ұмқј | мЎ°нҡҢмҲҳ |
|---|---|---|---|---|---|
| 455 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2020.01.02 | 12,447 | ||
| 454 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.10.14 | 27,577 | ||
| 453 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.28 | 13,611 | ||
| 452 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.28 | 11,765 | ||
| 451 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.08 | 13,073 | ||
| 450 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.08 | 13,643 | ||
| 449 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.08 | 12,518 | ||
| 448 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.07.25 | 13,028 | ||
| 447 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.07.25 | 13,259 | ||
| 446 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.07.25 | 11,939 | ||
| 445 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.06.03 | 16,040 | ||
| 444 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.05.29 | 17,058 | ||
| 443 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.05.22 | 16,521 | ||
| 442 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.05.22 | 16,219 | ||
| 441 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.04.01 | 16,674 | ||
| 440 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.04.01 | 17,673 | ||
| 439 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.23 | 29,622 | ||
| 438 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.23 | 18,216 | ||
| 437 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.21 | 21,564 | ||
| 436 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.09 | 17,139 | ||