HOME м•ҢлҰјмҶҢмӢқ кё°мҲ лҸҷн–Ҙ
| [мғқл¬јн•ҷм—°кө¬м •ліҙм„јн„°(BRIC)] мў…м–‘ лі‘мқён•ҷкіј 진н–үм—җм„ң нӣ„м„ұмң м „м Ғ мЎ°м Ҳмқёмһҗ, ліҖнҷ”мқёмһҗ, к·ёлҰ¬кі л§Өк°ңмқёмһҗ |
| мқҙлҰ„ : н‘ңмӨҖм„ұкіјн•ҷмӮ°нҢҖ | мһ‘м„ұмқј : 2018.02.14 | мЎ°нҡҢмҲҳ : 22202 |
| кё°кҙҖ : мғқл¬јн•ҷм—°кө¬м •ліҙм„јн„°(BRIC) |
|
мў…м–‘ лі‘мқён•ҷкіј 진н–үм—җм„ң нӣ„м„ұмң м „м Ғ мЎ°м Ҳмқёмһҗ, ліҖнҷ”мқёмһҗ, к·ёлҰ¬кі л§Өк°ңмқёмһҗ
KAIST / кіөм •л ¬
[мҡ”м•Ҫл¬ё]
мҳ¬н•ҙлҠ” вҖҳм•” м „кө¬ мң м „мһҗ(tumour progenitor genes)вҖҷмқҳ мЎҙмһ¬м—җ лҢҖн•ң м—°кө¬к°Җ гҖҠNatureгҖӢм§Җм—җ л°ңн‘ңлҗң м§Җ 10л…„мқҙ лҗҳлҠ” н•ҙмқҙлӢӨ. мқҙ мң м „мһҗл“ӨмқҖ лҸҢм—°ліҖмқҙк°Җ мқјм–ҙлӮҳкё°лҸ„ м „м—җ нӣ„м„ұмң м „м ҒмңјлЎң м•„мЈј мҙҲкё°м—җ л§қк°Җм ё л№„м •мғҒм Ғ 분нҷ”лҘј мқјмңјнӮЁлӢӨ. м§ҖлӮң 10л…„ лҸҷм•Ҳ мў…м–‘ нӣ„м„ұмң м „мІҙ(epigenetics)м—җ лҢҖн•ң м—°кө¬лҠ” м•” мң м „мһҗмҷҖ мӨ„кё°м„ёнҸ¬ лҰ¬н”„лЎңк·ёлһҳл°Қ мң м „мһҗ к°„мқҳ м—¬лҹ¬ мң мӮ¬м„ұмқ„ л°қнҳ”лӢӨ. мқҙлІҲ лҰ¬л·° л…јл¬ём—җм„ң м Җмһҗл“ӨмқҖ нӣ„м„ұмң м „м Ғ л§Өк°ңмқёмһҗ(epigenetic mediators), нӣ„м„ұмң м „м Ғ мЎ°м Ҳмқёмһҗ(epigenetic modulators), нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗ(epigenetic modifiers), мҙқ м„ёк°Җм§Җ мў…лҘҳмқҳ мң м „мһҗм—җ кҙҖн•ң мў…м–‘ нӣ„м„ұмң м „мІҙм—җ лҢҖн•ҙ л…јмқҳн•ҳкі мһҗ н•ңлӢӨ.
[лӘ© м°Ё]
1. м„ңлЎ
10л…„ м „, нӣ„м„ұмң м „м Ғ ліҖнҷ”лҠ” л°ңм•” мҙҲкё°м—җ мӨ„кё°м„ёнҸ¬лҠҘ(stemness)кіј кҙҖл Ё мһҲлҠ” к°ҖмғҒмқҳ вҖҳм•” м „кө¬ мң м „мһҗвҖҷ л°ңнҳ„м—җ мһҘм• лҘј мқјмңјнӮЁлӢӨкі ліҙкі лҗҳм—ҲлӢӨ. нӣ„м„ұмң м „м ҒмңјлЎң ліҖнҷ”лҗң м•” м „кө¬ мң м „мһҗлҠ” м•” л°ңмғқлҘ мқ„ мҰқк°ҖмӢңнӮӨкі мў…м–‘ 진н–ү мӨ‘ м•” м „мқҙ(metastasis)мҷҖ м№ЁмңӨ(invasion)мқ„ лҸ•лҠ” кІғмңјлЎң м•Ңл ӨмЎҢлӢӨ. лҳҗн•ң м•” м „кө¬ мң м „мһҗлҠ” н•ө кө¬мЎ°(nuclear architecture)мҷҖ м—јмғүм§Ҳ л°Җ집(chromatin compaction)мқ„ нҸ¬н•Ён•ң лӢӨм–‘н•ң нӣ„м„ұм Ғ ліҖнҷ”м—җ кё°лҠҘмқ„ н•ңлӢӨ. нӣ„м„ұмң м „м Ғ ліҖнҷ”м—җ мқҳн•ң мў…м–‘мқҖ мҶҢм•„ м•…м„ұ мў…м–‘м—җм„ң нҷңл°ңн•ң м—°кө¬к°Җ мқҙлЈЁм–ҙмЎҢлӢӨ. лӢӨм–‘н•ң мҶҢм•„м•”м—җм„ң мң м „м Ғ к·ёлҰ¬кі нӣ„м„ұмң м „м Ғ ліҖнҷ”лҘј 분м„қн•ң кІ°кіј лҸҢм—°ліҖмқҙк°Җ кҙҖм°°лҗҳм§Җ м•Ҡкұ°лӮҳ л“ңл¬јкІҢ кҙҖм°°лҗЁмқ„ л°ңкІ¬н•ҳмҳҖлӢӨ. мқҙлҠ” нӣ„м„ұм Ғ көҗлһҖмқҙ мў…м–‘мқ„ мң лҸ„н•Ёмқ„ мқҳлҜён•ңлӢӨ. мөңк·ј мҶҢм•„ нӣ„лҮҢ лҮҢмӢӨл§үм„ёнҸ¬мў…(paediatric hindbrain ependymomas)мқҳ мң м „мІҙ 분м„қ(genome sequencing) кІ°кіјлҠ” л°ҳліөлҗҳлҠ” мІҙм„ёнҸ¬ лҸҢм—°ліҖмқҙк°Җ м—ҶмқҢмқ„ ліҙм—¬мӨҖлӢӨ. л°ҳл©ҙ, нӣ„лҮҢ лҮҢмӢӨл§үм„ёнҸ¬мў…мқҳ нӣ„м„ұм Ғ ліҖнҷ”лЎң мқён•ң CpG island methylator phenotypeмқҖ PRG2 (polycomb repressive complex 2)мқҳ м „мӮ¬м Ғ м№Ёл¬ө(tran-tional silencing)мқ„ лӮҳнғҖлӮёлӢӨ. мқҙмҷҖ мң мӮ¬н•ҳкІҢ мҶҢм•„кё° м•…м„ұ лҮҢмў…м–‘, мҲҳлӘЁм„ёнҸ¬мў… (medulloblastoma)мқҖ мІҙм„ёнҸ¬ лҸҢм—°ліҖмқҙм—җ мқҳн•ҙ мң лһҳлҗҳм—Ҳм§Җл§Ң, м „мІҙм ҒмңјлЎң лӮ®мқҖ лҸҢм—°ліҖмқҙмңЁмқ„ лӮҳнғҖлӮёлӢӨ. мҲҳлӘЁм„ёнҸ¬мў…мқҳ DNA methylation sequencing кІ°кіј лҢҖк·ңлӘЁмқҳ м Җл©”нӢёнҷ”(hypomethylation)лЎң мқҙлЈЁм–ҙ진 нӣ„м„ұмң м „м Ғ ліҖнҷ”к°Җ кҙҖм°°лҗҳм—ҲлӢӨ. ліё лҰ¬л·° л…јл¬ём—җм„ңлҠ” м•” м „кө¬ мң м „мһҗмқҳ лҚ” лӘ…лЈҢн•ң мқҙн•ҙлҘј нҶөн•ҙ вҖҳнӣ„м„ұмң м „м Ғ л§Өк°ңмқёмһҗвҖҷлЎң мғҲлЎңмҡҙ мқҙлҰ„мқ„ л¶Җм—¬н•ҳкі лӢӨмӢң л…јмқҳн•ҳкі мһҗ н•ңлӢӨ.
2. мў…м–‘ нӣ„м„ұмң м „н•ҷ лӮҙ 3к°Җм§Җ мң м „мһҗ
мқҙлҜё м•” мң м „мһҗлҠ” л‘җ к°Җм§Җ 비-нӣ„м„ұмң м „м Ғ 분лҘҳ мІҙкі„лҘј м§ҖлӢҲкі мһҲлӢӨ; лҸҢм—°ліҖмқҙм„ұ 분лҘҳм—җ л”°лҘё мҡ°м„ұ л°ңм•” мң м „мһҗ(dominant oncogene), м—ҙм„ұ мў…м–‘ м–өм ң мң м „мһҗ(recessive tumour suppressor genes), м„ нғқм Ғ 분лҘҳм—җ л”°лҘё м•” мң л°ң мң м „мһҗ(drivers), м•” мң л°ңкіј л¬ҙкҙҖн•ң мң м „мһҗ(passengers)(н‘ң 1). нӣ„м„ұмң м „м Ғ кё°лҠҘм—җ л”°лҘё 분лҘҳ мӢңмҠӨн…ңмқҖ мў…м–‘ мң м „мһҗлҘј нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗ(modifiers), л§Өк°ңмқёмһҗ(mediators), к·ёлҰ¬кі мЎ°м Ҳмқёмһҗ(modulators)лЎң кө¬л¶„н•ҳмҳҖлӢӨ. нӣ„м„ұм Ғ ліҖнҷ”мқёмһҗлЎң л¬ҳмӮ¬лҗҳм—ҲлӢӨ. лҶҖлһҚкІҢлҸ„ м§ҖлӮң лӘҮ л…„к°„ м—°кө¬лҘј нҶөн•ҙ мў…м–‘ лӮҙ мғҒлӢ№мҲҳмқҳ лҸҢм—°ліҖмқҙм—җ нӣ„м„ұмң м „м Ғ мӢңмҠӨн…ңмқҳ лӘЁл“ л ҲлІЁм—җ мҳҒн–Ҙмқ„ лҜём№ҳлҠ” мң м „мһҗк°Җ нҸ¬н•Ёлҗҳм–ҙ мһҲмқҢмқҙ л°қнҳҖмЎҢлӢӨ. мҙҲкё° м•” м „кө¬ мң м „мһҗлЎң л¶ҲлҰ¬лҚҳ нӣ„м„ұмң м „м Ғ л§Өк°ңмқёмһҗлҠ” мһҗмІҙмқҳ лҸҢм—°ліҖмқҙліҙлӢӨлҠ” мЈјлЎң нӣ„м„ұмң м „м Ғ ліҖнҷ”лҘј н‘ңм ҒмңјлЎң н•ҳм—¬ м•” мӨ„кё°м„ёнҸ¬(cancer stem cells, м•”мӨ„кё°м„ёнҸ¬)мқҳ л°ңмғқмқ„ мң лҸ„н•ңлӢӨ. нӣ„м„ұмң м „м Ғ л§Өк°ңмқёмһҗлҠ” нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗмқҳ н‘ңм ҒмқҙлӢӨ. нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗлҠ” м•”кіј к·ё м „кө¬м„ёнҸ¬лҘј лҚ”мҡұ мӨ„кё°м„ёнҸ¬-мң мӮ¬ мғҒнғң(stem-like state)лЎң мң лҸ„н•ңлӢӨ. нӣ„м„ұм Ғ мЎ°м ҲмқёмһҗлҠ” ліҖнҷ”мқёмһҗмҷҖ л§Өк°ңмқёмһҗмқҳ мғҒмң„(upstream) мЎ°м Ҳ мң м „мһҗлЎң нҷҳкІҪм Ғ мҡ”мқё, мғҒн•ҙ, к°җм—ј к·ёлҰ¬кі лӢӨлҘё мҠӨнҠёл ҲмҠӨм—җ мқҳн•ҙ мЎ°м§Ғмқҙ мў…м–‘нҷ”лҗҳлҠ” кІғмқ„ мң лҸ„н•ңлӢӨ.
3. нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗ
лҢҖк·ңлӘЁ мў…м–‘ мӢңнҖҖмӢұмқ„ нҶөн•ң мӨ‘мҡ”н•ң л°ңкІ¬мқҖ нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗм—җ нҸӯл„“кІҢ мқјм–ҙлӮң лҸҢм—°ліҖмқҙмқҙлӢӨ. мқҙлҠ” DNA methylation, histone modificationкіј chromatin organizationмқ„ нҸ¬н•Ён•ң кұ°мқҳ лӘЁл“ нӣ„м„ұмң м „м Ғ кіјм •(epigenetic machinery)м—җ кҙҖм—¬н•ҳлҠ” кө¬м„ұл¬јл“ӨмқҙлӢӨ. DNA methylation кіјм •м—җ лҸҢм—°ліҖмқҙлҠ” мЈјлЎң нҳҲм•Ўн•ҷмғҒмқҳ м•…м„ұмў…м–‘(hematological malignancies)м—җм„ң мқјм–ҙлӮңлӢӨ. кіЁмҲҳмҷҖ лҰјн”„ м•…м„ұмў…м–‘м—җм„ң DNMT3A (DNA methyltransferase 3)мқҳ лҸҢм—°ліҖмқҙк°Җ мЈјлЎң кҙҖм°°лҗңлӢӨ. HSCs (hematopoietic stem cells) лӮҙ Dnmt3aлҘј м ңкұ°н•ң л§Ҳмҡ°мҠӨлҠ” HSCsмқҳ мһҗкё°мһ¬мғқ(selfrenewal)мқҙ мҰқк°Җн•ҳкі HSCsмқҳ 분нҷ”м—җ л¬ём ңк°Җ кҙҖм°°лҗҳм—ҲлӢӨ. мқҙлҠ” HSCs лӮҙ DNMT3Aмқҳ кІ°мӢӨмқҙ л°ұнҳҲлі‘ м „ н‘ңнҳ„нҳ•(pre-leukaemic phenotype)мқ„ лӮҳнғҖлғ„мқ„ ліҙм—¬мӨҖлӢӨ. DNA methylation м§Җмҡ°к°ңлЎң л¶ҲлҰ¬лҠ” TET2мқҳ лҸҢм—°ліҖмқҙлҠ” кіЁмҲҳ м•…м„ұмў…м–‘кіј T м„ёнҸ¬ лҰјн”„мў… к·ёлҰ¬кі м№ҳлЈҢк°Җ мүҪм§Җ м•ҠмқҖ AML (acute myeloid leukaemia)м—җм„ң л°ңкІ¬лҗңлӢӨ. TET2лҘј мғҒмӢӨн•ң л§Ҳмҡ°мҠӨлҠ” HSC мһҗкё°мһ¬мғқкіј кіЁмҲҳ мҰқмӢқмқҙ мҰқк°ҖлҗЁмқ„ ліҙмқёлӢӨ. м—јмғүм§Ҳ лҰ¬лӘЁлҚёл§Ғ кіјм •м—җ лҸҢм—°ліҖмқҙлҠ” кі нҳ•м•”м—җм„ң кҙҖм°°лҗңлӢӨ. Germline SMARCB1мқҳ лҸҢм—°ліҖмқҙлҠ” мҶҢм•„ к°„мғҒмў…м–‘(rhabdoid tumour)мқ„ мқјмңјнӮӨлҜҖлЎң мқҙ мң м „мһҗк°Җ м•” м–өм ң кё°лҠҘмқ„ к°Җм§Җкі мһҲмқҢмқ„ м•Ң мҲҳ мһҲлӢӨ. м•” мӢңнҖҖмӢұ м—°кө¬лҠ” SW1/SNF м—јмғүм§Ҳ лҰ¬лӘЁлҚёл§Ғ ліөн•©мІҙлҘј м•”нҳёнҷ”н•ҳлҠ” мң м „мһҗк°Җ мЈјмҡ” лҸҢм—°ліҖмқҙ н‘ңм Ғмһ„мқ„ л°қнҳ”лӢӨ. к·ё мҳҲлЎң, PBRM1 (polybromo 1)мҷҖ AR1D1A (AT-rich interaction domain 1A)к°Җ мһҲлӢӨ. Histone-modifying enzymes лҸҢм—°ліҖмқҙлҠ” лӢӨм–‘н•ң м•”м—җм„ң лӮҳнғҖлӮңлӢӨ. PRG2мқҳ н•өмӢ¬ кө¬м„ұмӣҗмқё EZH2мқҖ м•”мқҳ мў…лҘҳм—җ л”°лқј лӢӨм–‘н•ң кё°лҠҘмқ„ к°Җ진лӢӨ. Ezh2 лҸҢм—°ліҖмқҙлҘј нҷңм„ұнҷ”мӢңнӮЁ л§Ҳмҡ°мҠӨлҠ” germinal center кіјлӢӨ нҳ•м„ұкіј лҰјн”„мў… нҳ•м„ұмқ„ мҙү진мӢңмј°лӢӨ. л§Ҳмҡ°мҠӨ лӮҙ EZH2 мғҒмӢӨмқҖ T м„ёнҸ¬ кёүм„ұ лҰјн”„кө¬м„ұ л°ұнҳҲлі‘мқ„ мқјмңјмј°лӢӨ. мөңк·јм—җлҠ” мҶҢм•„ мӢ кІҪкөҗмў…(glioma) лӮҙ Lys27Met лҜёмҠӨм„јмҠӨ лҸҢм—°ліҖмқҙ(missense mutation)к°Җ EZH2мқҳ нҷңм„ұмқ„ м–өм ңмӢңнӮӨкі H3K27me3лҘј м „мІҙм ҒмңјлЎң к°җмҶҢмӢңнӮҙмқ„ л°қнҳ”лӢӨ. мқҙлҠ” EZH2к°Җ мЎ°м§Ғм—җ л”°лқј л°ңм•” мң м „мһҗ лҳҗлҠ” мў…м–‘ м–өм ңмһҗ лӘЁл‘җмқҳ кё°лҠҘмқ„ к°Җм§җмқ„ лӮҳнғҖлӮҙл©° мў…м–‘ лӮҙ нӣ„м„ұм Ғ ліҖнҷ”мқёмһҗмқҳ ліөмһЎм„ұмқ„ ліҙм—¬мӨҖлӢӨ.
4. нӣ„м„ұмң м „м Ғ л§Өк°ңмқёмһҗ
4.1 мӨ„кё°м„ёнҸ¬лҠҘкіј м „л¶„нҷ”лҠҘ мқёмһҗмқҳ кё°лҠҘ
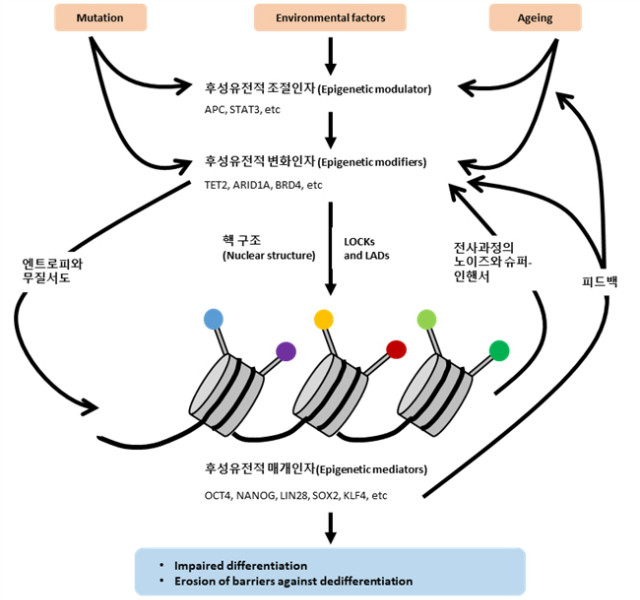
лӢӨм–‘н•ң мў…м–‘ лӮҙ нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗлҠ” IGF2 (insulin-like growth factor 2)мҷҖ к·ё н•ҳмң„ мЎ°м Ҳ мӢ нҳём—җ мҳҒн–Ҙмқ„ лҜём№ҳлҠ” мЎ°м Ҳ мҡ”мҶҢлҘј н‘ңм ҒмңјлЎң н•ңлӢӨ. IGF2мқҳ LOI (loss of imprinting)мқҖ IGF2мқҳ нӣ„м„ұмң м „м Ғ л°ңнҳ„мқ„ мЎ°м Ҳн•ңлӢӨ. IGF2мқҳ LOIлҠ” мҶҢм•„ л°°м•„м„ұ мў…м–‘(embryonal tumor)м—җм„ң мІҳмқҢ л°ңкІ¬лҗҳм—ҲлӢӨ. IGF2мқҳ кіјл°ңнҳ„мқҖ мӢ мӣҗл°ңм„ұ л°ӣм№Ё(nephrogenic rest)мқҳ кіјмҰқмӢқкіј мһҘ(colon) м „кө¬м„ёнҸ¬мқҳ мҰқмӢқмқ„ мҙү진н•ңлӢӨ. мқҙлҹ¬н•ң м—°кө¬лҠ” IGF2 мӢ нҳё кё°м „мқҙ м•”мӨ„кё°м„ёнҸ¬ мһҗкё°мһ¬мғқмқҳ мЈјмҡ” л§Өк°ңмһҗмһ„мқ„ ліҙм—¬мӨҖлӢӨ. IGF2мҷҖ IGF1 receptor(IGF1R) мӢ нҳёлҠ” мӨ„кё°м„ёнҸ¬ мһҗкё°мһ¬мғқкіј мҙҲкё° м „кө¬м„ёнҸ¬мқҳ мҰқмӢқм—җ кҙҖм—¬н•ҳлҠ” мЎ°м ҲмһҗлЎңмҚЁ мЈјлӘ©л°ӣкІҢ лҗҳм—ҲлӢӨ. мӨ„кё°м„ёнҸ¬-мң мӮ¬ н‘ңнҳ„нҳ•мңјлЎң м„ёнҸ¬ мғҒнғң ліҖнҷ”м—җ кё°м—¬н•ҳлҠ” мқёмһҗлҠ” мў…м–‘ л°ңлӢ¬м—җлҸ„ мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ҳлҜҖлЎң м Җмһҗл“ӨмқҖ мқҙлҹ¬н•ң мқёмһҗлҘј нӣ„м„ұмң м „м Ғ л§Өк°ңмһҗлЎң лӘ…лӘ…н•ҳмҳҖлӢӨ(к·ёлҰј 1, н‘ң 1). л°ңлӢ¬мқҙ 진н–үлҗҳлҠ” лҸҷм•Ҳ м„ёнҸ¬мқҳ м—јмғүм§Ҳ лӮҙ нӣ„м„ұмң м „м Ғ л§Өк°ңмһҗ-мң лһҳ ліҖнҷ”лҠ” н‘ңл©ҙм Ғ мң м—°м„ұ(phenotypic flexibility)кіј мқҙм§Ҳм„ұ(heterogeneity)лҘј мҰқк°ҖмӢңнӮЁлӢӨ. Feinberg л°•мӮ¬нҢҖмқҖ м•” м „кө¬ мң м „мһҗ к·ёлЈ№мқҙ мЎҙмһ¬н•ңлӢӨ к°Җм •н•ҳмҳҖлӢӨ. мқҙлҹ¬н•ң мң м „мһҗ 집лӢЁмқҖ нӣ„м„ұмң м „м Ғ л§Өк°ңмһҗ м№ҙн…Ңкі лҰ¬м—җ мҶҚн•ҳкі , NANOG, OCT4 к·ёлҰ¬кі WNT мӢ нҳёмҷҖ к°ҷмқҙ мһҳ м•Ңл Ө진 м „л¶„нҷ”лҠҘ мқёмһҗмқҙлӢӨ. л§Ҳмҡ°мҠӨ лӘЁлҚём—җм„ң NANOGмқҳ кіјл°ңнҳ„мқҖ кіјнҳ•м„ұ мҰқмӢқ(hyperplastic growth)мқ„ мҙү진함мқ„ кҙҖм°°н•ҳмҳҖлӢӨ. лҚ”л¶Ҳм–ҙ WNT мӢ нҳё кё°м „мқҳ кіјнҷңм„ұмқҖ лӮҙн”јм„ёнҸ¬м—җ NANOGмқҳ кіјл°ңнҳ„мқ„ мҙү진мӢңмјң м„ м•”(adenocarcinoma)мқ„ мқјмңјнӮЁлӢӨ. OCT4мқҳ кіјл°ңнҳ„ м—ӯмӢң л§Ҳмҡ°мҠӨ лӮҙн”јмЎ°м§Ғ лӮҙ кіјнҳ•м„ұкіј нҳ•м„ұ мқҙмғҒ(dysplastic)мқ„ к°Җм ёмҳӨл©° м „кө¬м„ёнҸ¬ poolмқҳ мҰқк°ҖмҷҖ -cateninWNT мӢ нҳё кё°м „ нҷңм„ұмқ„ мҰқлҢҖмӢңнӮЁлӢӨ. л§Өк°ңмқёмһҗлҠ” нӣ„м„ұмң м „м Ғ мғҒнғңм—җ мҳҒн–Ҙмқ„ лҜёміҗ 분нҷ”м„ёнҸ¬лҘј к·ңм •н•ңлӢӨ(к·ёлҰј 2). м„ёнҸ¬ 분нҷ”лҠ” м–өм ңм„ұ H3K9me2мҷҖ H3K9me3 modificationмқҳ лҢҖк·ңлӘЁ м°ЁлӢЁм—җ мқҳн•ҙ мқҙлЈЁм–ҙ진лӢӨ. мқҙлҠ” large organized chromatin K9 modifications (LOCKs)мңјлЎң л¶ҲлҰ¬л©° к°ҖліҖм„ұ(plasticity) мғҒнғңлҘј м§ҖлӢҲлҠ” ESCsмҷҖ м•”м„ёнҸ¬м—җм„ң кІ°н•Қлҗҳм–ҙ мһҲлӢӨ.
4.2 м•” мӨ„кё°м„ёнҸ¬мҷҖ кҙҖл Ём„ұ
мһҗкё°мһ¬мғқлҠҘмқ„ м§ҖлӢҲл©° лҜём„ұмҲҷ м„ёнҸ¬ мғҒнғңмқё м•”мӨ„кё°м„ёнҸ¬лҠ” м•”м—җм„ң мһҳ м—°кө¬лҗҳм–ҙ мһҲлӢӨ. мӨ„кё°м„ёнҸ¬-мң мӮ¬ м•”м„ёнҸ¬лҠ” м•”лҚ©м–ҙлҰ¬мқҳ мҶҢмҲҳ 집лӢЁм—җ л¶Ҳкіјн•ҳм§Җл§Ң м„ұмҲҷ кіјм •мқ„ нҶөн•ҙ мў…м–‘мқҳ мқҙм§Ҳм„ұм—җ мҳҒн–Ҙмқ„ лҜём№ңлӢӨ. м•”м„ёнҸ¬мқҳ к·јмӣҗмқҖ лҚ” 분нҷ”лҗң м„ёнҸ¬ лҳҗлҠ” лҚң 분нҷ”лҗң м„ёнҸ¬лЎң м•”мӨ„кё°м„ёнҸ¬мҷҖ лі„к°ңмқј мҲҳ мһҲлӢӨ. 비лЎқ м„ёнҸ¬мқҳ к·јмӣҗмқ„ к·ңлӘ…н•ҳлҠ”лҚ° м–ҙл ӨмӣҖмқҙ мһҲмңјлӮҳ мІҙм„ёнҸ¬ мӨ„кё°м„ёнҸ¬мҷҖ 분нҷ”лҗң м„ёнҸ¬ к°„мқҳ л¶Ҳк· нҳ•мқҖ л°ңм•”мқ„ мң л°ңн•ңлӢӨлҠ” м—°кө¬ ліҙкі к°Җ мһҲм—ҲлӢӨ. м •мғҒ мӨ„кё°м„ёнҸ¬мҷҖ л§Ҳм°¬к°Җм§ҖлЎң мӨ„кё°м„ёнҸ¬- мң мӮ¬ м•”м„ёнҸ¬лҠ” мһҳ мһҗлһ„ мҲҳ мһҲлҠ” мғқнғңм Ғ нҷҳкІҪм Ғ мң мӮ¬м„ұмқ„ м§ҖлӢҢлӢӨ. к·ё мҳҲлЎң 근섬мң м•„м„ёнҸ¬(myofibroblasts)лҠ” к°„м„ёнҸ¬ м„ұмһҘмқёмһҗ(hepatocyte growth factor)лҘј мғқмӮ°н•ҳм—¬ м•”мӨ„кё°м„ёнҸ¬ мғҒнғңлҘј мң м§Җн•ңлӢӨ. лҝҗл§Ң м•„лӢҲлқј 근섬мң м•„м„ёнҸ¬м—җм„ң 분비лҗң м„ұмһҘмқёмһҗлҠ” 분нҷ”лҗң м•”м„ёнҸ¬лҘј м•”мӨ„кё°м„ёнҸ¬ мғҒнғңлЎң лҸҢл ӨлҶ“мқ„ мҲҳ мһҲлӢӨлҠ” ліҙкі к°Җ мһҲлӢӨ.
н‘ң 1. м•” мң м „мһҗмқҳ 3к°Җм§Җ 분лҘҳ мӢңмҠӨн…ң 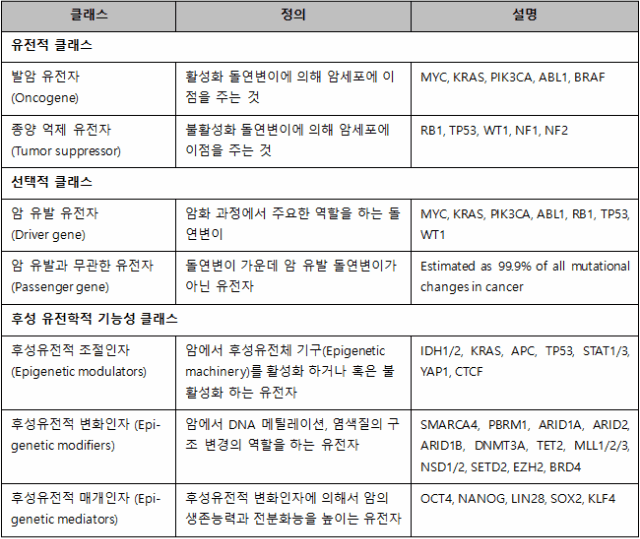
нӣ„м„ұмң м „м Ғ мЎ°м ҲмқёмһҗлҠ” 분нҷ”-нҠ№мқҙм Ғ нӣ„м„ұмң м „ мғҒнғңлҘј л¶Ҳм•Ҳм •нҷ”(destabilize)н•ҳкё° мң„н•ҙ нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗмқҳ нҷңм„ұ л°Ҹ мң„м№ҳ(localization)м—җ мҳҒн–Ҙмқ„ мӨҖлӢӨ. лҳҗн•ң нӣ„м„ұмң м „м Ғ л§Өк°ңмқёмһҗмқҳ л°ңнҳ„мқ„ к°„м ‘м ҒмңјлЎң мЎ°м Ҳн•ҳкі л§Өк°ңмқёмһҗ-мң лһҳ лҰ¬н”„лЎңк·ёлһҳл°Қмқ„ мҙү진н•ҳлҠ” лҚ° кҙҖм—¬н• кІғмңјлЎң 여겨진лӢӨ. мқҙлҹ¬н•ң нӣ„м„ұмң м „м Ғ мЎ°м Ҳмқёмһҗ мң м „мһҗлҠ” мЈјлЎң л°ңлі‘ л§җкё°м—җ лҸҢм—°ліҖмқҙ мң л°ңмқҳ н‘ңм Ғмқҙ лҗңлӢӨ(к·ёлҰј 1).
5.1 мў…м–‘ нҳ•м„ұ RAS мӢ нҳё
м•”-кҙҖл Ё мӢ нҳё кё°м „мқҖ нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗлҘј мЎ°м Ҳн•ңлӢӨ. мһҳ м•Ңл Ө진 мҳҲлЎң нӣ„м„ұмң м „м Ғ мЎ°м Ҳмқёмһҗ, мў…м–‘ нҳ•м„ұ RAS лҠ” м—јмғүм§Ҳ modifications мқ„ мЎ°м •н•ңлӢӨ. мў…м–‘ нҳ•м„ұ KRAS-мң лһҳ 비악м„ұ м„ёнҸ¬мқҳ ліҖнҳ•мқҖ KRAS-мң лһҳ TET enzymes мқҳ н•ҳн–Ҙ мЎ°м Ҳмқ„ н•„мҡ”лЎң н•ҳл©°, к·ё кІ°кіј DNA methylation мқҙ мҰқк°Җн•ҳкі мў…м–‘ м–өм ң мң м „мһҗмқҳ м№Ёл¬өмқ„ к°Җм ёмҳЁлӢӨ.
5.2 л§Ңм„ұ к°җм—ј лӮҙ мӢ нҳё кё°м „
м•”-мҙү진 кё°м „м—җ мқҳн•ң нӣ„м„ұмң м „мІҙ мЎ°м Ҳмқҳ лҳҗ лӢӨлҘё мҳҲлЎң л§Ңм„ұ к°җм—јмқ„ л§Өк°ңн•ҳлҠ” NF-пҒ«B мӢ нҳёк°Җ мһҲлӢӨ. WNT мӢ нҳё кё°м „мқҙ кіјнҷңм„ұлҗң л§Ҳмҡ°мҠӨ лӘЁлҚём—җм„ң NF-пҒ«BлҠ” м„ұмҲҷ м„ёнҸ¬мқҳ нғҲ분нҷ” (dedif-ferentiation)лҘј мң лҸ„н•ҳкі мӨ„кё°м„ёнҸ¬- мң мӮ¬ нҠ№м„ұмқҳ мҠөл“қкіј м•” к°ңмӢң(initiation)лҘј мҙү진н•ңлӢӨ. л°ңм•” мң м „мһҗ Srcмқҳ мқјмӢңм Ғ нҷңм„ұмқҖ NF-пҒ«Bк°Җ STAT3мҷҖ к°җм—ј мӮ¬мқҙнҶ м№ҙмқё IL-6мҷҖ н•Ёк»ҳ м–‘м„ұ нҷңм„ұ кё°м „(positive feedback loop)мқ„ мқҙлЈЁлҸ„лЎқ н•ңлӢӨ. нҠ№нһҲ, STAT3лҠ” OCT4, NANOG, к·ёлҰ¬кі SOX2 л°ңнҳ„мқҳ мң м§Җм—җ мӨ‘мҡ”н•ң мқёмһҗлЎң, м•”мқҙ мӨ„кё°м„ёнҸ¬ нҠ№м„ұмқ„ мҠөл“қн•ҳкі мғқмЎҙн•ҳлҠ”лҚ° мӨ‘мҡ”н•ң м—ӯн• мқ„ н•Ёмқҙ м•Ңл ӨмЎҢлӢӨ.
5.3 нӣ„м„ұмң м „м Ғ мЎ°м ҲмқёмһҗлЎңм„ң мў…м–‘ м–өм ң мң м „мһҗ
мў…м–‘ лӮҙ нӣ„м„ұмң м „м Ғ мЎ°м ҲмқёмһҗлҠ” м•” м–өм ң лӢЁл°ұм§Ҳ p53мқ„ нҸ¬н•Ён•ңлӢӨ(к·ёлҰј 1). м•”мқҳ p53 лҸҢм—°ліҖмқҙ кё°лҠҘ нҡҚл“қ(gain of function)мқҖ histonemodifying enzymes (MLL1, MLL2, MOZ)лҘј м•”нҳёнҷ”н•ҳлҠ” мң м „мһҗлҘј мҰқлҢҖмӢңмјң H3K9 acetylationкіј H3K4 trimethylationмқ„ мҰқк°ҖмӢңнӮЁлӢӨ. мқҙмҷҖ мң мӮ¬н•ҳкІҢ APC (adenomatous polyposis coli) м•” м–өм ң мң м „мһҗлҠ” DNA methylationмқҳ мЎ°м Ҳмқ„ нҶөн•ҙ мһҘ м„ёнҸ¬ 분нҷ”лҘј мЎ°м •н•ңлӢӨ. к·ё мҷём—җлҸ„ IDH1 (isocitrate dehydrogenase 1), FH (fumarate hydratase), SDH (succinate dehydrogenase)м—җ лҸҢм—°ліҖмқҙлҠ” м•”м„ёнҸ¬мқҳ нӣ„м„ұмң м „мІҙм—җ ліҖнҷ”лҘј мқјмңјнӮҙмқҙ кҙҖм°°лҗҳм—ҲлӢӨ.
5.4 л…ёнҷ” нҡЁкіј
л…ёнҷ”лҠ” нӣ„м„ұмң м „м Ғ мЎ°м ҲмқёмһҗмҷҖ л§Өк°ңмқёмһҗмқҳ н•ҳмң„ мӢ нҳём—җ нӣ„м„ұмң м „м Ғ ліҖнҷ”лҘј мқјмңјмјң л°ңм•” мң„н—ҳмқ„ мҰқлҢҖмӢңнӮЁлӢӨ. к°“ нғңм–ҙлӮң мң м•„мҷҖ 100м„ё л…ёмқёмқҳ 비көҗ м—°кө¬м—җм„ң лӮҳмқҙм—җ л”°лҘё DNA meth-ylation м°Ёмқҙк°Җ кҙҖм°°лҗҳм—ҲлӢӨ. лҳҗн•ң л…ёнҷ”м—җ л”°лҘё histonemodifying enzymesмқҳ мҶҗмғҒмқҖ мҲҳлӘ…м—җ мҳҒн–Ҙмқ„ лҜём№Ёмқҙ м—°кө¬лҗҳм—ҲлӢӨ. к·ё мҳҲлЎң мҳҲмҒңкј¬л§Ҳм„ м¶©м—җ H3K4 trimethylationмқҳ мҶҗмғҒкіј Dro-sophilaм—җ PRC2 ліөн•©мІҙмқҳ лҸҢм—°ліҖмқҙлҠ” мҲҳлӘ… м—°мһҘмқ„ к°Җм ёмҷ”лӢӨ. Werner мҰқнӣ„кө°кіј Hutchison-Gilford progeria мҰқнӣ„кө°мқ„ нҶөн•ң м—°кө¬м—җм„ңлҸ„ H3K9me3мқҳ кІ°мӢӨмқҙ м„ёнҸ¬ л…ёнҷ”лҘј лӮҳнғҖлғҲлӢӨ. л…ёнҷ”лҠ” нӣ„м„ұмң м „м Ғ ліҖнҷ”лЎң нҠ№м§•м§Җм–ҙм§Җл©° л…ёнҷ” кіјм • лӮҙ нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗмҷҖ л§Өк°ңмқёмһҗмқҳ кё°лҠҘм—җ лҢҖн•ң м—°кө¬лҠ” м•”мқҳ лі‘мқёкіј мң„н—ҳмқ„ мқҙн•ҙн•ҳлҠ” лҚ° мўӢмқҖ м •ліҙлҘј м ңкіөн• кІғмңјлЎң кё°лҢҖлҗңлӢӨ. нҷҳкІҪм Ғ л…ём¶ңмқҳ мҳҒн–Ҙ м•” мҳҲл°©мқ„ мң„н•ң л©”нӢё кіөм—¬мІҙ(methyl donor)мқҳ мӢқмқҙмҡ”лІ• к°ҖлҠҘм„ұм—җ лҢҖн•ң м—°кө¬лҠ” лҸҷл¬ј лӘЁлҚёкіј мқёк°„мқ„ нҶөн•ҙ мқҙлЈЁм–ҙмЎҢлӢӨ. мҘҗм—җм„ң л©”нӢё- кІ°н•Қ мӢқмқҙлҠ” к°„ мў…м–‘(liver neoplasm)мқ„ мң лҸ„н•ҳмҳҖлӢӨ. мқҙ лҸҷл¬јм—җм„ң мң м „мһҗ-нҠ№мқҙм Ғ DNA hypomethyla-tionмқҙ кҙҖм°°лҗҳм—ҲлӢӨ. мқҙмҷҖ мң мӮ¬н•ҳкІҢ м—ҪмӮ°(folate) лҳҗлҠ” л©”нӢ°мҳӨлӢҢмқҳ м ҖмӢқмқҙлҘј нҶөн•ҙ мқҙлЈЁм–ҙ진 мқёк°„ м—°кө¬лҠ” лҢҖмһҘ м„ мў…(colon adenoma)мқҳ мң„н—ҳмқ„ лҶ’нҳ”лӢӨ. лҳҗн•ң нҠ№м • л°ңм•”л¬јм§Ҳмқҳ л…ём¶ңмқҖ DNA methylomeм—җ ліҖнҷ”лҘј к°Җм ёмҷ”лӢӨ. м•”мқҙ м—ҶлҠ” кіјнқЎм—°мһҗмқҳ кё°кҙҖ мӢқлҸ„ мғҒн”ј(aerodigestive tract epithelium)лҠ” нҸҗм•”кіј кҙҖл Ёлҗң м—¬лҹ¬ мң м „мһҗмқҳ methylationм—җ ліҖнҷ”к°Җ кҙҖм°°лҗҳм—ҲлӢӨ. 비лЎқ нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗ, нҷҳкІҪм Ғ л…ём¶ң к·ёлҰ¬кі л°ңм•” мң„н—ҳ к°„мқҳ мғҒкҙҖкҙҖкі„м—җ лҢҖн•ң м—°кө¬к°Җ лӘ…л°ұнһҲ мқҙлЈЁм–ҙмЎҢмқҢм—җлҸ„ л¶Ҳкө¬н•ҳкі к·ё мӢ нҳё кё°м „м—җ лҢҖн•ң к№Ҡмқҙ мһҲлҠ” м—°кө¬к°Җ м•„м§ҒмқҖ л¶Ҳ충분н•ҳлӢӨ.
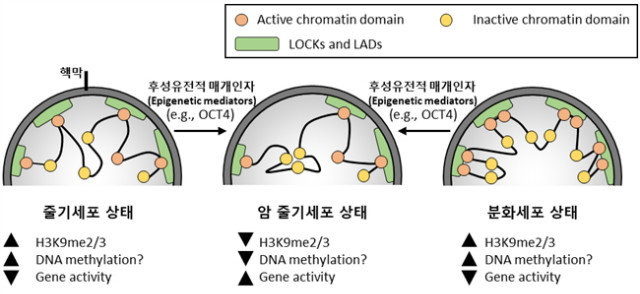
6. нғҲмЎ°м Ҳлҗң 3D н•ө кө¬мЎ°
л…ёнҷ”мҷҖ м•”м—җ л”°лҘё нӣ„м„ұмң м „мІҙмқҳ ліҖнҷ”лҠ” м—јмғүм§Ҳмқҳ 3D кө¬мЎ°мҷҖ мғҒнҳё м—°кҙҖлҗҳм–ҙ мһҲлӢӨ(к·ёлҰј 2). 분нҷ”лҗң м„ёнҸ¬лҠ” LADs (lamina-associated domains)мқҳ мЈјмҡ” л¶Җ분мқҙ LOCKsмҷҖ кІ№міҗм ё мһҲлӢӨ. нқҘлҜёлЎӯкІҢлҸ„, л§Ҳмҡ°мҠӨ лӮҙ нӣ„м„ұмң м „м Ғ л§Өк°ңмқёмһҗ мң м „мһҗ OCT4мқҳ н•ҳн–Ҙ мЎ°м ҲмқҖ laminaм—җ м—јмғүм§Ҳ 압축(compact chromatin)мқ„ нҳ•м„ұн•ңлӢӨ. мқҙлҠ” 3D м—јмғүм§Ҳ 압축мқҙ кі„нҶө нҠ№м •нҷ”(lineage specification) лҸҷм•Ҳ мң м „мһҗ м–өм ңлҘј мқјмңјнӮҙмқ„ ліҙм—¬мӨҖлӢӨ. Lamina лҠ” lysine-specific histone demethylase 1A (KDM1A), histone-lysine N-methyltransferase EHMT2, HDAC3 к·ёлҰ¬кі N-CoR ліөн•©мІҙмҷҖ к°ҷмқҖ м–өм ңм„ұ нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗлҘј нҶөн•ҙ м—јмғүм§Ҳ мғҒнғңлҘј мЎ°м Ҳн•ңлӢӨ. LOCKs мқҖ м„ёнҸ¬ кё°м–өмқ„ мң м§Җн•ҳлҠ” лҚ° мӨ‘мҡ”н•ң кё°лҠҘмқ„ н•ҳлҠ”лҚ°, TGF-пҒў(tumour growth factor-) -мң лһҳ EMT(epithelial-to-mesenchymal transition)лҠ” LOCKsмқҳ LSD1-л§Өк°ң H3K9me2 кІ°н•Қм—җ мқҳн•ҙ мқҙлЈЁм–ҙ진лӢӨ. лӢӨм–‘н•ң м•”м„ёнҸ¬м—җм„ң H3K9me2мҷҖ H3K9me3мқҳ кІ°н•Қмқҙ кҙҖм°°лҗҳм—Ҳмңјл©° мқҙлҠ” м„ёнҸ¬ кё°м–ө мғҒмӢӨмқ„ мң лҸ„н•ҳкі EMT-кҙҖл Ё м—јмғүм§Ҳ ліҖнҷ”лҘј к°Җм ёмҷҖ м•”м„ёнҸ¬к°Җ к°ҖліҖм„ұмқ„ м§ҖлӢҳмқ„ ліҙм—¬мӨҖлӢӨ(к·ёлҰј 2).
7.1 нӣ„м„ұмң м „м Ғ к°ҖліҖм„ұмқҳ лҢҖмҳҒм—ӯ
м•” 진нҷ”мқҳ мЈјмҡ” 추진л ҘмқҖ ліҖнҷ”лҗң нҷҳкІҪм—җм„ң м•”м„ёнҸ¬мқҳ м„ұмһҘмқҙ мҡ©мқҙн•ҳлҸ„лЎқ мһ¬л№ лҘҙкІҢ м„ нғқлҗң нӣ„м„ұмң м „м Ғ л¬ҙм§Ҳм„ңлҸ„(epigenetic stochaticity)мқҳ л°ңмғқм—җ мһҲлӢӨ. мқҙлҹ¬н•ң л¬ҙм§Ҳм„ңм Ғ ліҖнҷ”мҷҖ нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗ, нӣ„м„ұмң м „м Ғ мЎ°м Ҳмқёмһҗ, к·ёлҰ¬кі нӣ„м„ұ мң м „м Ғ л§Өк°ңмқёмһҗ к°„мқҳ мғҒнҳёмһ‘мҡ©м—җ лҢҖн•ң мқҙн•ҙлҠ” м•” 진нҷ”мҷҖ м•”мқҳ м№ҳлЈҢ м Җн•ӯмқ„ л§үлҠ”лҚ° н•„мҲҳм ҒмқҙлӢӨ. мӢӨн—ҳмқ„ нҶөн•ҙ мў…м–‘ лӮҙ нӣ„м„ұмң м „мІҙмқҳ кұ°лҢҖ мҳҒм—ӯм—җм„ң л¬ҙм§Ҳм„ңм Ғ DNA methylation ліҖнҷ”к°Җ кҙҖм°°лҗҳм—ҲлӢӨ. мқҙлҹ¬н•ң л¬ҙм§Ҳм„ңм Ғ нӣ„м„ұмң м „ ліҖнҷ”лҠ” м „мһҘ мң м „мІҙ(genome-wide)м—җм„ң мқјм–ҙлӮҳм§Җ м•ҠлҠ”лӢӨ. м•” мң м „мІҙмқҳ 1/3м—җм„ң мқјм •м№ҳ м•ҠкІҢ л©”нӢёнҷ”лҗң кө¬м—ӯмқҙ л°ңкІ¬лҗҳм—ҲлӢӨ.
7.2 л„ӨнҠёмӣҢнҒ¬ м—”нҠёлЎңн”јмҷҖ н•ө кө¬мЎ°
мөңк·ј м—°кө¬лҠ” м„ёнҸ¬ мқҙм§Ҳм„ұмқ„ л„ӨнҠёмӣҢнҒ¬ м—”нҠёлЎңн”ј(network entropy)лЎң л¬ҳмӮ¬н•ҳкі л„ӨнҠёмӣҢнҒ¬ м—”нҠёлЎңн”јмқҳ м •лҸ„м—җ л”°лқј л°ңлӢ¬ мһ мһ¬л Ҙмқ„ м¶”м •н•ңлӢӨ. лӢӨмӢң л§җн•ҙ, лҶ’мқҖ м—”нҠёлЎңн”јлҘј м§ҖлӢҲлҠ” мқҙм§Ҳм Ғ м „л¶„нҷ”лҠҘ мӨ„кё°м„ёнҸ¬ 집лӢЁмқҖ лҚ” м„ұмҲҷн•ң phenotypesмңјлЎң 분нҷ”н• мҲҳ мһҲлҠ” лӢӨм–‘н•ҳкі нҸӯл„“мқҖ кё°м „мқ„ к°Җ진лӢӨ. м •мғҒ 분нҷ”мҷҖ мң мӮ¬н•ҳкІҢ м•”мӨ„кё°м„ёнҸ¬лҠ” лҶ’мқҖ м—”нҠёлЎңн”јлҘј к°Җм§Җл©° мқҙлҠ” м•”м„ёнҸ¬ліҙлӢӨ лҶ’лӢӨ. н•ҳм§Җл§Ң м•” мӨ„кё°м„ёнҸ¬лҠ” м •мғҒ м„ёнҸ¬(normal counter-part)м—җ 비н•ҙ лӮ®мқҖ м—”нҠёлЎңн”јлҘј м§ҖлӢҢлӢӨ. мқҙлҠ” л°ңм•” кё°м „мқҙ мҡ°м„ұмһ„мқ„ к°„м ‘м ҒмңјлЎң ліҙм—¬мӨҖлӢӨ. м—”нҠёлЎңн”јм—җ л”°лҘё м„ёнҸ¬ мғҒнғңмқҳ ліҖнҷ”лҠ” нӣ„м„ұмң м „м ҒмңјлЎң мЎ°м ҲлҗңлӢӨ. л°°м•„мӨ„кё°м„ёнҸ¬ лӮҙ RNAмқҳ л№„к· м§Ҳм Ғ л°ңнҳ„(noisy expression) нҢЁн„ҙмқҖ 분нҷ” к°ҖлҠҘм„ұмқ„ лӮҳнғҖлӮҙкі мқҙлҠ” DNA methylationм—җ ліҖнҷ”лҘј к°Җм ёмҳЁлӢӨ.
7.3 л¬ҙм§Ҳм„ң нӣ„м„ұмң м „м Ғ ліҖнҷ” л©”м»ӨлӢҲмҰҳ
мөңк·ј м—°кө¬лҠ” лҶ’мқҖ л¬ҙм§Ҳм„ң нӣ„мғқмң м „м Ғ ліҖнҷ”(stochastic epigenetic variation)мқҳ 분мһҗ л©”м»ӨлӢҲмҰҳмқҙ нҷңм„ұ к·ёлҰ¬кі 비нҷңм„ұ м—јмғүм§Ҳ нҷҳкІҪ мӮ¬мқҙмқҳ кіөк°„ 분нҷ”(spatial separation) л°Ҹ м—јмғүм§Ҳ мң лҸҷм„ұ(mobility)м—җ мқҙмғҒмқ„ мқјмңјнӮӨлҠ”лҚ° кҙҖм—¬н• кІғмқҙлқј мҳҲмғҒн•ңлӢӨ. м—јмғүм§Ҳ modificationмқҳ к°Җм—ӯм„ұм—җ л”°лқј, н•өл§үмқ„ л– лӮң LADsмҷҖ LOCKsмқҳ мһ¬л°°м№ҳ(relocation)лҠ” м–өм ңм„ұ marksмқҳ м№ЁмӢқ(erosion)кіј м „мӮ¬ нҷңм„ұмқҳ мҰқк°ҖмҷҖ кҙҖл Ё мһҲлӢӨ. Laminaм—җ 비нҷңм„ұ м—јмғүм§Ҳ лҸ„л©”мқёмқҳ лҸҷмӣҗ(recruitment)мқҖ LOCKsмқҳ мқҙм§Ҳм Ғ м№ЁмӢқмқ„ мң лҸ„н•ҳкі мқҙ лҸ„л©”мқём—җ мң„м№ҳн•ң мң м „мһҗмқҳ л¶Ҳк·ңм№ҷм Ғ мһ¬нҷңм„ұмқ„ мқјмңјнӮЁлӢӨ.
8. мҰқнҸӯмһҗ мқҙмҡ©
мҰқнҸӯмһҗ мҡ”мҶҢ(enhancer elements)лҠ” л°ңлӢ¬ к·ёлҰ¬кі л°ңм•” кё°м „ мӢ нҳёлҘј нҶөн•©н•ңлӢӨ. м—јмғүм§Ҳмқҳ м „мІҙ м§ҖлҸ„лҠ” м„ёнҸ¬ к°„ мң м „мһҗ л°ңнҳ„мқ„ лҜём„ён•ҳкІҢ мЎ°м Ҳн•ҳлҠ” л…ём¶ңлҗң кёҙ enhancer-promoter loopsмқ„ мқҙлЈЁкі мһҲлӢӨ. м„ёнҸ¬нҳ•-нҠ№мқҙм Ғ мң м „мһҗ л°ңнҳ„мқҖ м—¬лҹ¬ мҰқнҸӯмһҗ мҡ”мҶҢмқҳ 집лӢЁ(clustering)м—җ мқҳн•ҙ мқјм–ҙлӮңлӢӨ. мҶҢмң„ мҠҲнҚј мқён•ём„ң(super-enhancer)лқј л¶ҲлҰ¬лҠ” мҰқнҸӯмһҗлҠ” лӢӨм–‘н•ң м„ёнҸ¬ мҡҙлӘ…-кІ°м • кё°м „ мӢ нҳёлҘј нҶөн•©н•ҳл©° м„ёнҸ¬ мғҒнғңлҘј кІ°м •н•ҳлҠ” мң м „мһҗмқҳ м „мӮ¬лҘј мқјмңјнӮЁлӢӨ.
9. 진лӢЁкіј м№ҳлЈҢ кҙҖл Ём„ұ
м•”мқ„ мқјмңјнӮ¬ мҲҳ мһҲлҠ” нӣ„м„ұмң м „м Ғ мЎ°м ҲмқёмһҗмҷҖ ліҖнҷ”мқёмһҗ лӮҙ лҸҢм—°ліҖмқҙм—җ лҢҖн•ң мӨ‘мҡ”м„ұмқҙ к°•мЎ°лҗҳкі мһҲлӢӨ. н•ҳм§Җл§Ң л…ёнҷ”мҷҖ нҷҳкІҪм—җ мқҳн•ң м •мғҒ мЎ°м§Ғмқҳ лӢӨнҒҙлЎ (polyclonal) нӣ„м„ұмң м „м Ғ мҶҗмғҒмқҖ мҳӨлһң мӢңк°„мқҙ кұёлҰ°лӢӨ. к·ёлҹ¬лҜҖлЎң м№ҳлЈҢ н‘ңм ҒмңјлЎңм„ң нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗмқҳ мӮ¬мҡ©мқҖ мқҙлҜё мЎҙмһ¬н•ҳлҠ” м•”мқ„ лҢҖмғҒмңјлЎң мқҙлЈЁм–ҙм ём•ј н•ңлӢӨ. м•” мӨ„кё°м„ёнҸ¬мҷҖ м•” 진нҷ”мқҳ мӢңмһ‘м—җм„ң нӣ„м„ұмң м „м Ғ л¶Ҳм•Ҳм „м„ұмқҖ нӣ„м„ұмң м „м Ғ л§Өк°ңмқёмһҗлҘј м–өм ңн•ЁмңјлЎңмҚЁ н•ӯм•” м Җн•ӯмқ„ лӮ®м¶”кі м•”мӨ„кё°м„ёнҸ¬лҘј м ңкұ°н• мҲҳ мһҲмқҢмқ„ лӮҳнғҖлӮёлӢӨ. к·ё мҳҲлЎң ITE (2- (1вҖҷH-indole-3вҖҷ-carbonyl)-thiazole-4-carboxylic acid methyl ester)лҠ” OCT4мқҳ promoterм—җ л¶Җм°©н•ҳм—¬ к·ёкІғмқҳ м „мӮ¬лҘј м–өм ңн•ңлӢӨ. кІ°кіј, мӨ„кё°м„ёнҸ¬-мң мӮ¬ м„ёнҸ¬мқҳ л°ңм•”м„ұмқ„ м–өм ңн•ңлӢӨ.
10. кІ°лЎ кіј м „л§қ
м§ҖлӮң 10л…„к°„ мғҲлЎңмҡҙ м—°кө¬л“ӨмқҖ м•” нӣ„м„ұмң м „мІҙк°Җ мў…м–‘ лҜём„ёнҷҳкІҪ лӮҙм—җм„ң нӣ„м„ұмң м „м Ғ ліҖнҷ”лҘј кі„мҶҚм ҒмңјлЎң мһ¬мғқ(regeneration)н•Ёмқ„ ліҙм—¬мЈјм—ҲлӢӨ. м—¬лҹ¬ м—°кө¬л“Ө мӨ‘ к°ҖмһҘ мқёмғҒ к№ҠмқҖ л°ңкІ¬мқҖ мң м „мІҙмқҳ нҠ№м • лҸ„л©”мқёмқҙ л…ёнҷ”-, нҷҳкІҪ-, к·ёлҰ¬кі л°ңм•”л¬јм§Ҳ(carcinogen)-мң лһҳ нӣ„м„ұмң м „м Ғ ліҖнҷ”м—җ нҠ№нһҲ м·Ём•Ҫн•ҳм—¬ л°ңм•” кіјм • мӨ‘ л¬ҙм§Ҳм„ңм Ғ нӣ„м„ұмң м „ ліҖнҷ”лҘј мҙүл°ңн• мҲҳ мһҲлӢӨлҠ” мӮ¬мӢӨмқҙлӢӨ. ліё л…јл¬ём—җм„ң м Җмһҗл“ӨмқҖ м•” л°ңлӢ¬кіј 진н–ү мӨ‘ нӣ„м„ұмң м „мІҙмқҳ мһ¬л°°м№ҳ(rewire)м—җ кҙҖм—¬н•ҳлҠ” мң м „мһҗ нҠ№м§•мқ„ 분м„қн•ҳм—¬ мғҲлЎӯкІҢ 분лҘҳн•ҳмҳҖлӢӨ. нӣ„м„ұ мң м „м Ғ ліҖнҷ”мқёмһҗмҷҖ нӣ„м„ұмң м „м Ғ мЎ°м ҲмқёмһҗлҠ” м•”м—җм„ң мЈјлЎң лҸҢм—°ліҖмқҙк°Җ мқјм–ҙлӮҳ мһҲмңјл©° мқҙл“ӨмқҖ к°„м ‘м ҒмңјлЎң м—јмғүм§Ҳ modificationм—җ ліҖнҷ”лҘј мқјмңјнӮӨлҠ” л°ңм•” мӢ нҳёлҘј м „лӢ¬н•ҳм—¬ м•” л°ңлӢ¬мқ„ мҙү진н•ңлӢӨ. лҳҗн•ң нӣ„м„ұмң м „м Ғ л§Өк°ңмқёмһҗлҠ” м•”мӨ„кё°м„ёнҸ¬ мғҒнғңм—җм„ң м•…м„ұ мў…м–‘кіј м „мқҙк°Җ мқјм–ҙлӮҳлҸ„лЎқ н‘ңл©ҙм Ғ к°ҖліҖм„ұм—җ мҳҒн–Ҙмқ„ мӨҖлӢӨ. нҳ„мһ¬ мң м „мІҙмқҳ 3D кө¬мЎ°мҷҖ н•ө кө¬мЎ°м—җ л”°лҘё м•”мқҳ нӣ„м„ұмң м „м Ғ ліҖнҷ”м—җ лҢҖн•ң кҙҖмӢ¬мқҙ мҰқк°Җн•ҳкі мһҲлӢӨ. н•ө кө¬мЎ°мҷҖ enhancer-promoter communicationмқ„ мЎ°м Ҳн•ҳлҠ” мқёмһҗлҠ” нӣ„м„ұмң м „м Ғ ліҖнҷ”мқёмһҗ нҷңм„ұмқ„ мӢңкіөк°„м ҒмңјлЎң мЎ°м •н•ҳм—¬ нӣ„м„ұмң м „мІҙлҘј мЎ°м Ҳн• кІғмңјлЎң 여겨진лӢӨ. ліё л…јл¬ёмқҳ м Җмһҗл“ӨмқҖ м•” м „кө¬мІҙ мёЎл©ҙм—җм„ң нӣ„м„ұмң м „мІҙн•ҷм—җ лҢҖн•ң м§ҖлӮң 10л…„к°„мқҳ м—°кө¬лҘј мҡ”м•Ҫ м •лҰ¬н•ҳкі мһҲлӢӨ. 비лЎқ м•„м§Ғ л§ҺмқҖ м—°кө¬к°Җ мқҙлЈЁм–ҙм ём•ј н•ҳм§Җл§Ң ліё л…јл¬ёмқ„ нҶөн•ҙ RNA, мў…м–‘ мқҙм§Ҳм„ұ, м „мӮ¬ л¬ҙм§Ҳм„ңнҷ”, м„ёнҸ¬ мӢ нҳёмҷҖ к°җм—ј, к·ёлҰ¬кі enhancer-promoter мғҒнҳёмһ‘мҡ© л“ұ лӢӨм–‘н•ң мёЎл©ҙм—җм„ң мў…м–‘ мң м „мІҙн•ҷмқҳ мөңмӢ м§ҖкІ¬м—җ лҢҖн•ҙ мӮҙнҺҙ ліј мҲҳ мһҲм—ҲлӢӨ.
...................(кі„мҶҚ)
м¶ңмІҳ : мғқл¬јн•ҷм—°кө¬м •ліҙм„јн„°(BRIC) (л°”лЎңк°Җкё°)
|
IP : 192.168.31.*** 
![[мғқл¬јн•ҷм—°кө¬м •ліҙм„јн„°(BRIC)] мў…м–‘ лі‘мқён•ҷкіј 진н–үм—җм„ң нӣ„м„ұмң м „м Ғ мЎ°м Ҳмқёмһҗ, ліҖнҷ”мқёмһҗ, к·ёлҰ¬кі л§Өк°ңмқёмһҗ кІҢмӢңл¬јлЎң л°”лЎңк°Җкё°,QRмҪ”л“ң https://yesme.kiom.re.kr/Trend/articles/view/tableid/tech/id/1424](/attach/qrcode/board_1424.png)
|
| лІҲнҳё | нҢҢмқј | м ңлӘ© | мқҙлҰ„ | мһ‘м„ұмқј | мЎ°нҡҢмҲҳ |
|---|---|---|---|---|---|
| 455 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2020.01.02 | 12,398 | ||
| 454 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.10.14 | 27,496 | ||
| 453 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.28 | 13,563 | ||
| 452 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.28 | 11,708 | ||
| 451 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.08 | 13,037 | ||
| 450 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.08 | 13,578 | ||
| 449 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.08 | 12,464 | ||
| 448 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.07.25 | 12,993 | ||
| 447 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.07.25 | 13,219 | ||
| 446 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.07.25 | 11,910 | ||
| 445 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.06.03 | 15,958 | ||
| 444 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.05.29 | 16,999 | ||
| 443 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.05.22 | 16,478 | ||
| 442 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.05.22 | 16,145 | ||
| 441 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.04.01 | 16,614 | ||
| 440 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.04.01 | 17,602 | ||
| 439 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.23 | 29,537 | ||
| 438 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.23 | 18,164 | ||
| 437 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.21 | 21,487 | ||
| 436 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.09 | 17,105 | ||