HOME м•ҢлҰјмҶҢмӢқ кё°мҲ лҸҷн–Ҙ
| [BRIC] лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘мқҳ 진нҷ”м Ғ мқҳмқҳмҷҖ м—°кө¬лҸҷн–Ҙ |
| мқҙлҰ„ : н‘ңмӨҖм„ұкіјн•ҷмӮ°нҢҖ | мһ‘м„ұмқј : 2017.11.07 | мЎ°нҡҢмҲҳ : 34916 |
| кё°кҙҖ : мғқл¬јн•ҷм—°кө¬м •ліҙм„јн„°(BRIC) |
|
лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘мқҳ 진нҷ”м Ғ мқҳмқҳмҷҖ м—°кө¬лҸҷн–Ҙ
к№ҖмІңм•„ / м„ңмҡёлҢҖн•ҷкөҗ
[лӘ© м°Ё]
1. м„ нҳ•м—јмғүмІҙмҷҖ н…”лЎңлҜём–ҙмқҳ 진нҷ” 2. лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘ 3. лӢӨм–‘н•ң мғқл¬јмқҳ лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘ 4. мҙҲкё° 진нҷ” лӢ№мӢң н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘ л°Ҹ кІ°лЎ 5. м°ёкі л¬ён—Ң
[мҡ”м•Ҫл¬ё]
м„ нҳ• м—јмғүмІҙк°Җ мң м§Җлҗҳкё° мң„н•ҙм„ңлҠ” лҒқл¶Җ분мқҙ DNA мҲҳлҰ¬ кё°мһ‘м—җ мқҳн•ҙ м№ҳлЈҢлҗҳм§Җ м•Ҡм•„м•ј н•ңлӢӨ. лҳҗн•ң DNA мӨ‘н•©нҡЁмҶҢлҠ” лҒқ л¶Җ분мқ„ мҷ„м „нһҲ ліөм ңн• мҲҳ м—Ҷкё° л•Ңл¬ём—җ мқҙ л¬ём ңлҘј н•ҙкІ°н•ҳм§Җ м•Ҡмңјл©ҙ м—јмғүмІҙлҠ” м„ёнҸ¬ 분м—ҙмқҙ 진н–үлҗЁм—җ л”°лқј 짧아м§ҖкІҢ лҗңлӢӨ. 진н•өмғқл¬јмқҖ мқҙ л¬ём ңлҘј н•ҙкІ°н•ҳкё° мң„н•ҙ м—јмғүмІҙ лҒқмқ„ ліҙнҳён•ҳлҠ” н…”лЎңлҜём–ҙлқјлҠ” кө¬мЎ°л¬јмқ„ л°ңлӘ…н–ҲлӢӨ. н…”лЎңлҜём–ҙлҠ” мқјл°ҳм ҒмңјлЎң м—ӯм „мӮ¬ нҡЁмҶҢмқё н…”лЎңлЁёл ҲмқҙмҰҲм—җ мқҳн•ҙ мң м§ҖлҗҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ. н•ҳм§Җл§Ң мһҗм—°мғҒм—җлҠ” нӣЁм”¬ лӢӨм–‘н•ң н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘мқҙ мЎҙмһ¬н•ңлӢӨ. 진нҷ” кіјм •м—җм„ң н…”лЎңлЁёл ҲмқҙмҰҲлҘј мһғм–ҙлІ„лҰ° к°ңмІҙ, мһҗм—°м ҒмңјлЎңлҠ” н…”лЎңлЁёл ҲмқҙмҰҲлҘј мқҙмҡ©н•Ём—җлҸ„ л¶Ҳкө¬н•ҳкі мқёмң„м ҒмңјлЎң н…”лЎңлЁёл ҲмқҙмҰҲ 비-мқҳмЎҙм Ғмқё лҢҖм•Ҳм Ғ кё°мһ‘(ALT)мқ„ нҡҚл“қн• мҲҳ мһҲлҠ” к°ңмІҙ, к°ңмІҙ лӮҙм—җм„ң нӣ„мІңм Ғмқё ліҖнҷ”лЎң мҠӨмҠӨлЎң н…”лЎңлҜём–ҙлҘј мң м§Җн•ҳлҠ” лҠҘл Ҙмқ„ нҡҚл“қн•ң м•”м„ёнҸ¬мқҳ мЎҙмһ¬ л“ұ лӢӨм–‘н•ң н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘мқҳ мӮ¬лЎҖл“Өмқ„ мў…н•©м ҒмңјлЎң кі л Өн•ҙліҙл©ҙ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘ 진нҷ”мқҳ лӢӨм–‘м„ұкіј ліөмһЎм„ұмқ„ мүҪкІҢ м§җмһ‘н• мҲҳ мһҲлӢӨ. ліё лҸҷн–ҘлҰ¬нҸ¬нҠём—җм„ңлҠ” ALT кё°мһ‘мқҙ мІҳмқҢ ліҙкі лҗң м•” м„ёнҸ¬л¶Җн„° лӢӨм–‘н•ң лӘЁлҚё лҸҷл¬јкіј мһҗм—°кі„к№Ңм§Җ л„җлҰ¬ л°ңкІ¬лҗҳлҠ” ALT кё°мһ‘мқ„ мҶҢк°ңн•ҳкі , 진нҷ”м Ғ мқҳмқҳлҘј кі м°°н•ҳкі мһҗ н•ңлӢӨ.
1. м„ нҳ•м—јмғүмІҙмҷҖ н…”лЎңлҜём–ҙмқҳ 진нҷ”
진н•өмғқл¬јмқҳ нғ„мғқ кіјм •м—җм„ң н•ҳлӮҳмқҳ мӣҗнҳ• м—јмғүмІҙк°Җ м—¬лҹ¬ к°ңмқҳ м„ нҳ• м—јмғүмІҙлЎң лӮҳлүҳлҠ” м „нҷҳмқҙ мқјм–ҙлӮ¬лӢӨ. м„ нҳ• м—јмғүмІҙмқҳ нғ„мғқ мқҙмң м—җ лҢҖн•ҙм„ л§ҺмқҖ к°Җм„Өмқҙ мЎҙмһ¬н•ҳлҠ”лҚ°, к°ҖмһҘ л„җлҰ¬ л°ӣм•„л“Өм—¬м§ҖлҠ” к°Җм„ӨмқҖ 1м°Ё к°җмҲҳ분м—ҙ кіјм •м—җм„ң мқјм–ҙлӮҳлҠ” көҗм°Ё(crossover)к°Җ мӣҗнҳ• м—јмғүмІҙм—җ мқјм–ҙлӮҳл©ҙ м„ёнҸ¬ 분м—ҙ кіјм •м—җм„ң м—јмғүмІҙк°Җ мһҳлӘ» 분лҰ¬лҗ к°ҖлҠҘм„ұмқҙ лҶ’м•„м„ң м„ нҳ•м—јмғүмІҙм—җ 비көҗ мҡ°мң„к°Җ мғқкІјлӢӨлҠ” к°Җм„ӨмқҙлӢӨ[1]. мқҙл ҮкІҢ м„ нҳ•м—јмғүмІҙлҘј м–»кІҢ лҗң 진н•өмғқл¬јмқҖ көҗм°ЁлҘј нҶөн•ҙ мң м „м •ліҙлҘј көҗнҷҳн•ҳл©° мң м „м Ғ лӢӨм–‘м„ұмқ„ мҰқлҢҖмӢңнӮӨлҠ” мқҙм җмқ„ лҲ„лҰҙ мҲҳ мһҲкІҢ лҗҳм—ҲлӢӨ.
к·ёлҹ°лҚ° мқҙл ҮкІҢ нғ„мғқн•ң м„ нҳ•м—јмғүмІҙлҘј мң м§Җн•ҳкё° мң„н•ҙм„ м„ёнҸ¬м—җ лӮҙмһ¬н•ң л‘җ к°Җм§Җ мң„нҳ‘мқ„ к·№ліөн•ҙм•јл§Ң н–ҲлӢӨ. м„ нҳ•м—јмғүмІҙмқҳ лҒқл¶Җ분мқҖ мӣҗнҳ• м—јмғүмІҙк°Җ лҒҠм–ҙ진 нҳ•нғңмҷҖ ліём§Ҳм ҒмңјлЎң лӢӨлҘҙм§Җ м•Ҡкё° л•Ңл¬ём—җ, 진нҷ” кіјм • мӨ‘ м„ нҳ•м—јмғүмІҙк°Җ мөңмҙҲлЎң л“ұмһҘн–Ҳмқ„ л•Ң, м„ёнҸ¬лҠ” м„ нҳ•м—јмғүмІҙмқҳ лҒқл¶Җ분мқ„ DNA мҶҗмғҒмңјлЎң м—¬кІјмқ„ к°ҖлҠҘм„ұмқҙ лҶ’лӢӨ. л”°лқјм„ң м„ нҳ•м—јмғүмІҙлҘј мң м§Җн•ҳкё° мң„н•ҙм„ DNA мҶҗмғҒмқ„ мқём§Җн•ҳлҠ” м№ҳлЈҢ кё°мһ‘мқҙ м„ нҳ• м—јмғүмІҙ лҒқл¶Җ분мқ„ м„ңлЎң м—°кІ°н•ҳм§Җ лӘ»н•ҳкІҢ л§үлҠ” нҠ№лі„н•ң л°©м–ҙ м „лһөмқҙ н•„мҡ”н•ҳлӢӨ[2,3]. лҳҗн•ң DNA мӨ‘н•©нҡЁмҶҢлҠ” кө¬мЎ°м ҒмңјлЎң ліөм ңлҘј мӢңмһ‘н•ҳкё° мң„н•ҙ RNA н”„лқјмқҙлЁё(primer)мқҳ 3вҖҷ OHк°Җ н•„мҡ”н•ҳлҜҖлЎң ліөм ңлҘј лҒқлӮҙкі н”„лқјмқҙлЁёк°Җ м ңкұ°лҗң к°ҖмһҘ лҒқл¶Җ분мқ„ мҷ„м „нһҲ ліөм ңн•ҳм§Җ лӘ»н•ҳкІҢ лҗңлӢӨ. мқҙлҘј вҖңл§җлӢЁ-ліөм ң л¬ём ңвҖқлқјкі л¶ҖлҘҙлҠ”лҚ°, мқҙ л¬ём ңк°Җ н•ҙкІ°лҗҳм§Җ м•Ҡмңјл©ҙ лҒқл¶Җ분л¶Җн„° м җм җ м§§м•„м ё мң м „м •ліҙ мҶҢмӢӨлЎң мқҙм–ҙм§Ҳ мҲҳ л°–м—җ м—ҶлӢӨ(к·ёлҰј 1)[4].
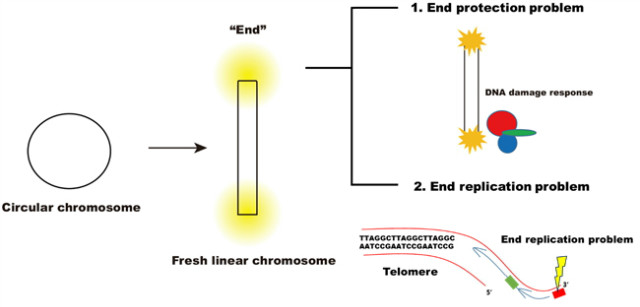 к·ёлҰј 1. м„ нҳ•м—јмғүмІҙмқҳ л‘җ к°Җм§Җ л¬ём ң
м„ нҳ•м—јмғүмІҙмқҳ л‘җ к°Җм§Җ л¬ём ңлҘј н•ҙкІ°н•ҳкё° мң„н•ҙ, 진н•өмғқл¬јмқҖ м—јмғүмІҙ лҒқл¶Җ분м—җ DNA-лӢЁл°ұм§Ҳ ліөн•©мІҙмқё н…”лЎңлҜём–ҙ(telomere)лҘј лҸ„мһ…н•ҳм—¬ ліҙнҳён•ҳлҠ” м „лһөмқ„ мұ„нғқн•ҳкІҢ лҗҳм—ҲлӢӨ[5]. н…”лЎңлҜём–ҙ м„ңм—ҙм—җ кІ°н•©н•ҳлҠ” лӢЁл°ұм§Ҳ ліөн•©мІҙлҠ” лҒқл¶Җ분мқ„ DNA мҶҗмғҒ мӢ нҳёлЎңл¶Җн„° ліҙнҳён•ҳкі , DNA мӨ‘н•©нҡЁмҶҢк°Җ м•„лӢҢ лӢӨлҘё л°©мӢқмңјлЎң н…”лЎңлҜём–ҙлҘј ліөм ңн•ҳлҠ” л°©мӢқмқ„ мұ„нғқн•ҳм—¬ лҒқл¶Җ분мқҙ м җ진м ҒмңјлЎң 짧아м§ҖлҠ” кІғмқ„ л§үм•ҳлӢӨ. к°ҖмһҘ л„җлҰ¬ м•Ңл Ө진 л°©мӢқмқҖ н…”лЎңлЁёл ҲмқҙмҰҲ(telomerase)лқјлҠ” м—ӯм „мӮ¬ мӨ‘н•©нҡЁмҶҢ(reverse tranase)лҘј мқҙмҡ©н•ҳм—¬ лҒқл¶Җ분мқ„ ліөм ңн•ҳлҠ” л°©мӢқмқҙлӢӨ[6]. 2009л…„ л…ёлІЁ мғқлҰ¬мқҳн•ҷмғҒмқ„ мҲҳмғҒн•ң мқҙ кё°мһ‘мқҖ н…”лЎңлЁёл ҲмқҙмҰҲк°Җ мһҗмІҙм ҒмңјлЎң к°Җ진 н…”лЎңлҜём–ҙ мЈјнҳ•мқ„ мқҙмҡ©н•ҳм—¬, м—ӯм „мӮ¬ л°©мӢқмңјлЎң м—јмғүмІҙ лҒқл¶Җ분м—җ нҠ№м • м—јкё°м„ңм—ҙ, мқёк°„мқҳ кІҪмҡ° TTAGGGмқ„ л°ҳліөм ҒмңјлЎң л¶ҷм—¬ н…”лЎңлҜём–ҙлҘј нҳ•м„ұн•ңлӢӨ. мқҙл ҮкІҢ нҳ•м„ұлҗң н…”лЎңлҜём–ҙ м—јкё°м„ңм—ҙмқ„ нҠ№мқҙм ҒмңјлЎң мқём§Җн•ҳлҠ” DNA кІ°н•© лӢЁл°ұм§Ҳл“Өмқҙ н•©міҗм ё DNA-лӢЁл°ұм§Ҳ ліөн•©мІҙмқё н…”лЎңлҜём–ҙлҘј мҷ„м„ұн•ҳкІҢ лҗңлӢӨ[7].
н…”лЎңлЁёл ҲмқҙмҰҲлҘј мқҙмҡ©н•ҳм—¬ лҒқл¶Җ분мқ„ ліҙнҳён•ҳлҠ” м „лһөмқҖ 진н•өмғқл¬јм—җ л„җлҰ¬ нҚјм ёмһҲлӢӨ[8]. л”°лқјм„ң мқҙ м „лһөмқҖ 진н•өмғқл¬јмқҳ 진нҷ” мҙҲкё°м—җ лӮҳнғҖлӮ¬мқ„ кІғмңјлЎң мҳҲмғҒлҗңлӢӨ. к·ёлҹ¬лӮҳ н…”лЎңлЁёл ҲмқҙмҰҲк°Җ м•„лӢҢ лӢӨлҘё л°©мӢқмңјлЎң м—јмғүмІҙ лҒқл¶Җ분мқ„ ліҙнҳён•ҳлҠ” мҳҲмҷём Ғмқё мғқл¬ј м—ӯмӢң мЎҙмһ¬н•ңлӢӨ. лҢҖн‘ңм Ғмқё лӘЁлҚё лҸҷл¬јмқё мҙҲнҢҢлҰ¬к°Җ мҶҚн•ң нҢҢлҰ¬лӘ©(Diptera)мқҖ 진нҷ” кіјм •м—җм„ң 5лІҲмқҳ лҸ…лҰҪм Ғмқё н…”лЎңлЁёл ҲмқҙмҰҲ мҶҗмӢӨмқҙ мһҲм—ҲлӢӨ[9,10]. мҙҲнҢҢлҰ¬лҠ” н…”лЎңлЁёл ҲмқҙмҰҲ мҶҗмӢӨлЎң мң м§Җн•ҳкё° нһҳл“Өм–ҙ진 кё°мЎҙмқҳ н…”лЎңлҜём–ҙ л°ҳліөм„ңм—ҙмқ„ л ҲнҠёлЎңнҠёлһңмҠӨнҸ¬мЎҙ (retrotransposon)мңјлЎң лҢҖмІҙн•ҳм—¬ мғҲлЎңмҡҙ н…”лЎңлҜём–ҙлҘј нҳ•м„ұн–ҲлӢӨ[11]. лҳҗн•ң нҢҢлҰ¬лӘ© к№”л”°кө¬кіјмқҳ кіӨ충мқё нӮӨлЎңл…ёл¬ҙмҠӨ н…җнғ„мҠӨ(Chironomous tentans)мқҳ кІҪмҡ°м—җлҠ” 350 bp к°Җлҹүмқҳ л°ҳліө м„ңм—ҙмқҙ н…”лЎңлҜём–ҙлҘј нҳ•м„ұн•ңлӢӨ. нҢҢлҰ¬лӘ©лҝҗл§Ң м•„лӢҲлқј м–‘нҢҢм—җм„ңлҸ„ 375 bp к°Җлҹүмқҳ л°ҳліө м„ңм—ҙкіј rDNA м„ңм—ҙмқҙ н…”лЎңлҜём–ҙлҘј нҳ•м„ұн•ңлӢӨ(к·ёлҰј 2)[12]. мҰү, н…”лЎңлЁёл ҲмқҙмҰҲлҘј нҶөн•ң мң м§Җкё°мһ‘мқҙ лҒқл¶Җ분мқ„ мң м§Җн•ҳлҠ” мң мқјн•ң кё°мһ‘мқҙ м•„лӢҲл©°, мӢңнҖҖмӢұ кё°мҲ мқҳ л°ңм „мңјлЎң лӘЁлҚё лҸҷл¬јмқ„ л„ҳм–ҙ лӢӨм–‘н•ң мў…мқҳ м—јкё°м„ңм—ҙмқҙ к·ңлӘ…лҗҳкі мһҲлҠ” нҳ„мһ¬мқҳ нқҗлҰ„м—җ лҜёлЈЁм–ҙ ліҙл©ҙ н…”лЎңлЁёл ҲмқҙмҰҲк°Җ м•„лӢҢ л°©мӢқмңјлЎң н…”лЎңлҜём–ҙлҘј нҳ•м„ұн•ҳлҠ” вҖҳмҳҲмҷём Ғмқё мў…вҖҷ н•ӯлӘ©мқҖ м җм җ кёём–ҙм§Ҳ кІғмңјлЎң мҳҲмғҒлҗңлӢӨ.
 к·ёлҰј 2. ALTмқҳ лӢӨм–‘н•ң мӮ¬лЎҖл“Ө
н…”лЎңлЁёл ҲмқҙмҰҲк°Җ н…”лЎңлҜём–ҙлҘј нҳ•м„ұн•ҳлҠ” кё°мһ‘мқҖ м„ёнҸ¬ мЈјкё°м—җ л”°лқј мһҳ мЎ°м Ҳлҗҳл©°, нҳ•м„ұлҗң н…”лЎңлҜём–ҙлҘј ліҙнҳён•ҳкё° мң„н•ң лӢЁл°ұм§Ҳмқҳ кІ°н•© л°Ҹ мғҒнҳёмһ‘мҡ© м—ӯмӢң лӢӨм–‘н•ң мЎ°м Ҳ мқёмһҗм—җ мқҳн•ҙ н”„лЎңк·ёлһҳл°Қ лҗҳм–ҙ мӣҖм§ҒмқёлӢӨ[13]. к·ёл ҮлӢӨл©ҙ мқҙлҘј лҢҖмІҙн•ҳлҠ” лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘мқҖ кё°мЎҙмқҳ мЎ°м Ҳ л„ӨнҠёмӣҢнҒ¬лҘј л¬ҙл„ҲлңЁлҰ¬кі мғҲлЎңмҡҙ мЎ°м Ҳ л„ӨнҠёмӣҢнҒ¬лҘј нҳ•м„ұн•ҳкІҢ лҗ к№Ң? м–ҙл–»кІҢ н…”лЎңлЁёл ҲмқҙмҰҲлҘј мһғм–ҙлІ„лҰ° мқҙнӣ„ л№ лҘҙкІҢ мғҲлЎңмҡҙ мЎ°м Ҳ л„ӨнҠёмӣҢнҒ¬лЎң м „нҷҳ лҗ мҲҳ мһҲм—Ҳмқ„к№Ң? ліё лҸҷн–ҘлҰ¬нҸ¬нҠём—җм„ңлҠ” мқҙлҹ¬н•ң мқҳл¬ём—җ лҢҖн•ң лӢөмқ„ мөңк·јк№Ңм§Җ лӢӨм–‘н•ң лӘЁлҚё лҸҷл¬јкіј м•”м„ёнҸ¬м—җм„ң мҲҳн–үлҗң лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘ м—°кө¬м—җм„ң м°ҫм•„ліҙкі мһҗ н•ңлӢӨ.
2. лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘
м—јмғүмІҙ лҒқмқ„ к°җмӢёлҠ” лӢЁмҲңн•ң л¬јлҰ¬м Ғ ліҙнҳёл§үмңјлЎңл§Ң м—¬кІЁмЎҢлҚҳ н…”лЎңлҜём–ҙлҠ” вҖҳм„ёнҸ¬ нғҖмқҙлЁёвҖҷ кё°лҠҘмқҙ л°қнҳҖм§Җл©ҙм„ң л§ҺмқҖ мЈјлӘ©мқ„ л°ӣкІҢ лҗҳм—ҲлӢӨ[14]. лӢЁм„ёнҸ¬ мғқл¬јм—җм„ң мІҳмқҢ л°ңкІ¬лҗҳм–ҙ лӘЁл“ м„ёнҸ¬к°Җ к°Җм§Җкі мһҲмқ„ кІғмқҙлқјкі м—¬кІЁмЎҢлҚҳ н…”лЎңлЁёл ҲмқҙмҰҲ нҷңм„ұмқҙ лӢӨм„ёнҸ¬ мғқл¬јмқҳ кІҪмҡ° мқјл¶Җ м ңн•ңм Ғмқё м„ёнҸ¬кө°м—җм„ңл§Ң лӮҳнғҖлӮ¬лӢӨ[15]. л”°лқјм„ң н…”лЎңлЁёл ҲмқҙмҰҲ нҷңм„ұмқҙ м—ҶлҠ” лҢҖл¶Җ분мқҳ мқёк°„ мІҙм„ёнҸ¬мқҳ н…”лЎңлҜём–ҙ кёёмқҙлҠ” м„ёнҸ¬ 분м—ҙмқ„ кұ°л“ӯн•Ём—җ л”°лқј м§§м•„м ё мӨ‘мҡ”н•ң мң м „м •ліҙк°Җ мҶҗмӢӨлҗ мҲҳл°–м—җ м—Ҷмқ„ кІғмқҙлқјкі мҳҲмғҒлҗҳм—ҲлӢӨ. к·ёлҹ¬лӮҳ мҳҲмғҒкіј лӢ¬лҰ¬ н…”лЎңлҜём–ҙк°Җ нҠ№м •н•ң м—ӯм№ҳ мқҙн•ҳлЎң 짧아м§Җл©ҙ н…”лЎңлҜём–ҙк°Җ мҲЁкІЁмЈјлҚҳ лҒқл¶Җ분мқҙ DNA мҶҗмғҒ л¶Җмң„лЎң мқём§Җлҗҳм–ҙ, P53, P21 л“ұкіј к°ҷмқҖ мқјл Ёмқҳ мІҙнҒ¬нҸ¬мқёнҠё лӢЁл°ұм§Ҳмқҳ мһ‘лҸҷмңјлЎң м„ёнҸ¬к°Җ лҚ” 분м—ҙн•ҳм§Җ м•Ҡкі л©Ҳ추лҠ” м„ёнҸ¬ л…ёнҷ”(cellular senescence)к°Җ лӮҳнғҖлӮҳкІҢ лҗңлӢӨ[16].
м„ёнҸ¬ л…ёнҷ”лҠ” к°ңмІҙмқҳ мҲҳлӘ…мқ„ м ңн•ңн•ҳлҠ” л¶Җм •м Ғмқё нҳ„мғҒмІҳлҹј ліҙмқҙм§Җл§Ң к·ё мқҙл©ҙм—җлҠ” м„ёнҸ¬ 분м—ҙ нҡҹмҲҳлҘј м ңн•ңн•ҳм—¬ м„ёнҸ¬мқҳ мқҙкё°м Ғмқё 분м—ҙмқ„ м–өм ңн•ҳлҠ” кё°лҠҘмқҙ мһҲлӢӨ. л”°лқјм„ң м„ёнҸ¬мқҳ мЎ°м Ҳ мӢ нҳёлҘј л¬ҙмӢңн•ҳкі , л¬ҙм ңн•ңмңјлЎң 분м—ҙн•ҳлҠ” м•”м„ёнҸ¬мқҳ кІҪмҡ° м„ёнҸ¬ л…ёнҷ”лҘј л¬ҙл Ҙнҷ”н•ҳкё° мң„н•ҙ н…”лЎңлҜём–ҙ нғҖмқҙлЁёк°Җ мјңм§Җм§Җ м•ҠлҸ„лЎқ мЎ°м Ҳн• мҲҳ мһҲлҠ” лҠҘл Ҙмқҙ н•„мҡ”н•ҳлӢӨ[17]. мӢӨм ңлЎң мІҙм„ёнҸ¬м—җм„ң мң лһҳн•ң л§ҺмқҖ м•”м„ёнҸ¬м—җм„ң н…”лЎңлЁёл ҲмқҙмҰҲ нҷңм„ұмқҙ кҙҖм°°лҗҳм—ҲлӢӨ[18]. мқҙлҹ¬н•ң л°ңкІ¬мқҖ м•”м„ёнҸ¬мқҳ н•өмӢ¬ кё°мһ‘мқё м„ёнҸ¬ 분м—ҙ лҠҘл Ҙмқ„ м ңм–ҙн• мҲҳ мһҲмқ„ кІғмқҙлқјлҠ” нқ¬л§қмқ„ л¶Ҳлҹ¬мқјмңјмј°кі , л§ҺмқҖ м—°кө¬мһҗк°Җ н…”лЎңлЁёл ҲмқҙмҰҲлҘј м–өм ңн•ҳлҠ” л°©мӢқмңјлЎң м•”мқ„ м ңм–ҙн•ҙліҙл Өкі н–ҲлӢӨ. к·ёлҹ¬лӮҳ м—°кө¬мһҗл“Өмқҳ кё°лҢҖмҷҖлҠ” лӢ¬лҰ¬ н…”лЎңлЁёл ҲмқҙмҰҲлҠ” м•”м„ёнҸ¬к°Җ н…”лЎңлҜём–ҙ нғҖмқҙлЁёлҘј м ңм–ҙн•ҳлҠ” мң мқјн•ң л°©лІ•мқҙ м•„лӢҲм—ҲлӢӨ. н…”лЎңлЁёл ҲмқҙмҰҲ нҷңм„ұ м—ҶмқҙлҸ„ кі„мҶҚ 분м—ҙн• мҲҳ мһҲлҠ” м•”м„ёнҸ¬л“Өмқҙ мҶҚмҶҚ л°ңкІ¬лҗҳм—Ҳкі , н…”лЎңлЁёл ҲмқҙмҰҲ 비-мқҳмЎҙм Ғмқё л°©мӢқмңјлЎң н…”лЎңлҜём–ҙлҘј мң м§Җн•ҳлҠ” кё°мһ‘мқ„ мҙқм№ӯн•ҳм—¬ лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘(Alternative Lengthening of Telomeres, м•Ҫм–ҙлЎң ALT)лқј лӘ…лӘ…н•ҳмҳҖлӢӨ[19].
нҳ„мһ¬к№Ңм§Җ мҲҳн–үлҗң мқёк°„ м•”м„ёнҸ¬ м—°кө¬ кІ°кіјм—җ л”°лҘҙл©ҙ н…”лЎңлЁёл ҲмқҙмҰҲ нҷңм„ұмқҙ м—ҶлҠ” м•”м„ёнҸ¬к°Җ 10~15% к°Җлҹү мЎҙмһ¬н•ңлӢӨ[20]. нҠ№нһҲ к°„м—Ҫ мЎ°м§Ғ(mesenchymal tissues)м—җм„ң мң лһҳн•ң мңЎмў… м•”(sarcoma)м„ёнҸ¬м—җм„ңлҠ” н…”лЎңлЁёл ҲмқҙмҰҲ нҷңм„ұмқҙ м—ҶлҠ” м„ёнҸ¬мқҳ 비мңЁмқҙ м Ҳл°ҳ мқҙмғҒмқҙл©°, glioblastoma multi-forme(GBM), pancreatic neuroendocrine tumors (PanNET)м—җм„ңлҸ„ ALT л°ңлі‘ нҷ•лҘ мқҙ лҶ’лӢӨ(к·ёлҰј 3)[21-23]. мқҙл Үл“Ҝ нҠ№м • мЎ°м§Ғм—җм„ңлҠ” ALTк°Җ м•”м„ёнҸ¬ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘мқҳ мӨ‘мҡ”н•ң кё°мһ‘мқј лҝҗл§Ң м•„лӢҲлқј, ALT л°ңлі‘ нҷ•лҘ мқҙ лҶ’м§Җ м•ҠмқҖ м•”м„ёнҸ¬мқҳ кІҪмҡ°м—җлҸ„ н…”лЎңлЁёл ҲмқҙмҰҲ м–өм ңм ңлҘј мІҳлҰ¬н•ҳкІҢ лҗҳл©ҙ ALT нҷңм„ұмқ„ к°Җ진 м„ёнҸ¬л§Ң мӮҙм•„лӮЁмқ„ мҲҳ мһҲлӢӨ. мӢӨм ңлЎң мқёк°„ лҢҖмһҘм•”м„ёнҸ¬м—җ н…”лЎңлЁёл ҲмқҙмҰҲ м–өм ңм ңлҘј мІҳлҰ¬н•ң кІҪмҡ° ALT м•”м„ёнҸ¬к°Җ лӮҳнғҖлӮ¬мңјл©°[24], мҘҗм—җм„ң н…”лЎңлЁёл ҲмқҙмҰҲлҘј м§ҖмҶҚм ҒмңјлЎң м–өм ңн•ҳмҳҖмқ„ л•ҢлҸ„ ALT нҷңм„ұмқ„ к°Җ진 м•”м„ёнҸ¬к°Җ лӮҳнғҖлӮ¬лӢӨ[25].
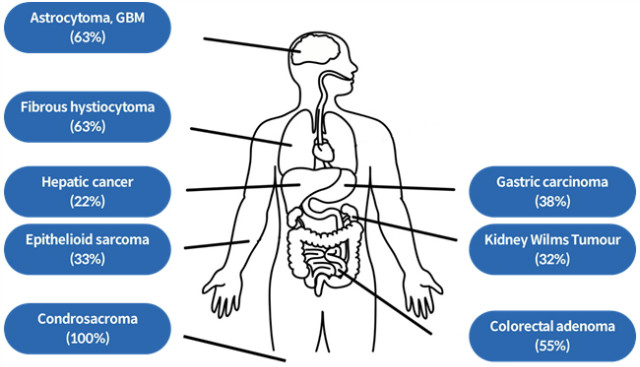 к·ёлҰј 3. ALT м•” л°ңлі‘ нҷ•лҘ мқҙ лҶ’мқҖ мЎ°м§Ғ
ALTлҠ” м–ҙл–Ө л°©мӢқмңјлЎң н…”лЎңлҜём–ҙ кёёмқҙлҘј лҠҳлҰ¬лҠ” кІғмқјк№Ң? лӘЁл“ ALTлҠ” к°ҷмқҖ л°©мӢқмңјлЎң н…”лЎңлҜём–ҙ кёёмқҙлҘј мЎ°м Ҳн•ҳкі мһҲмқ„к№Ң? нҳ„мһ¬к№Ңм§Җ ALT кё°мһ‘ м—°кө¬лҠ” мЈјлЎң мқёк°„ кіЁмңЎмў…(osteosarcoma) мң лһҳ м•”м„ёнҸ¬мқё U-2 OS м„ёнҸ¬мЈјмҷҖ 섬мң м•„м„ёнҸ¬(fibroblast)лҘј м•”мңјлЎң нҳ•м§Ҳм „нҷҳмӢңнӮЁ лӘҮ мў…лҘҳмқҳ м„ёнҸ¬мЈјм—җм„ң мҲҳн–үлҗҳм—ҲлӢӨ. мқҙ м—°кө¬л“Өм—җ л”°лҘҙл©ҙ ALTлҠ” мғҒлҸҷ мһ¬мЎ°н•©мқ„ нҶөн•ҙ н…”лЎңлҜём–ҙлҘј ліөм ңн•ҳл©°[26], к·ё кіјм •м—җм„ң м•„м§Ғ л°қнҳҖм§Җм§Җ м•ҠмқҖ кё°мһ‘мқ„ нҶөн•ҙ ліҖмқҙ н…”лЎңлҜём–ҙ м„ңм—ҙ(мЈјлЎң TCAGGGмҷҖ TGAGGGлЎң ліҖнҳ•лҗЁ)мқҙ ліёлһҳ н…”лЎңлҜём–ҙ м„ңм—ҙ(TTAGGG) мӮ¬мқҙмӮ¬мқҙлЎң лҒјм–ҙ л“Өм–ҙк°Җ лӢӨлҘё нҳ•нғңмқҳ н…”лЎңлҜём–ҙлҘј кө¬м„ұн•ҳкІҢ лҗңлӢӨ[27]. мғҲлЎӯкІҢ мғқкІЁлӮң ліҖмқҙ н…”лЎңлҜём–ҙ м„ңм—ҙм—җлҠ” ліёлһҳ н…”лЎңлҜём–ҙ м„ңм—ҙкіјлҠ” лӢӨлҘё лӢЁл°ұм§Ҳмқҙ кІ°н•©н•ңлӢӨ. н•ө мҲҳмҡ©мІҙ(nuclear receptor) лӢЁл°ұм§Ҳмқё COUP-TF2мҷҖ TF4к°Җ ліҖмқҙ н…”лЎңлҜём–ҙ м„ңм—ҙкіј кІ°н•©н•ҳкі , лүҙнҒҙл ҲмҳӨмўҖ лҰ¬лӘЁлҚёл§Ғ лӢЁл°ұм§Ҳмқё NURD-ZNF827 ліөн•©мІҙлҘј лҒҢм–ҙмҷҖм„ң ALT н…”лЎңлҜём–ҙмқҳ м—јмғүм§Ҳ кө¬мЎ°лҘј л°”кҫјлӢӨ[28].
ліҖмқҙ н…”лЎңлҜём–ҙ м„ңм—ҙкіј мғҲлЎңмҡҙ кІ°н•© лӢЁл°ұм§Ҳмқҙ л§Ңл“Өм–ҙлӮё мғҲлЎңмҡҙ н…”лЎңлҜём–ҙ м—јмғүм§ҲмқҖ DNA мҶҗмғҒ мӢ нҳёлҘј мҷ„м „нһҲ м–өм ңн•ҳлҠ” ліёлһҳ н…”лЎңлҜём–ҙ м—јмғүм§Ҳкіј лӢ¬лҰ¬ DNA мҶҗмғҒ мӢ нҳёлҘј мҷ„м „нһҲ л§ү진 лӘ»н•ңлӢӨ. н…”лЎңлҜём–ҙ кІ°н•© лӢЁл°ұм§Ҳмқ„ мҷ„м „нһҲ м ңкұ°н•ҳл©ҙ н…”лЎңлҜём–ҙ л¶Җмң„лҘј DNA мҶҗмғҒмңјлЎң мқём§Җн•ҳкі , мқҙлҘј м№ҳлЈҢн•ҳкё° мң„н•ҙ 비-мғҒлҸҷм„ұ л§җлӢЁ м ‘н•©(Non-homologous end joining) кё°мһ‘мқҙ мһ‘лҸҷн•ҳм—¬ лҒқ л¶Җмң„лҘј н•ҳлӮҳлЎң м—°кІ°н•ҳкІҢ лҗңлӢӨ. к·ёлҹ°лҚ° ALT н…”лЎңлҜём–ҙм—җ лӮҙмһ¬лҗң DNA мҶҗмғҒ мӢ нҳёлҠ” 비-мғҒлҸҷм„ұ л§җлӢЁм ‘н•©мқҙ нҷңм„ұнҷ”лҗ м •лҸ„лЎң к·№мӢ¬н•ҳ진 м•Ҡм§Җл§Ң, мғҒлҸҷ мһ¬мЎ°н•©мқҙ мһ‘лҸҷн• мҲҳмӨҖмқҳ м ҒлӢ№н•ң мӢ нҳёк°Җ лҗҳм–ҙ, мқҙ кё°мһ‘мқҙ н…”лЎңлҜём–ҙлҘј лҠҳлҰ¬кІҢ лҗ кІғмңјлЎң мҳҲмғҒлҗңлӢӨ[29].
мқҙлҹ¬н•ң ALT н…”лЎңлҜём–ҙ м—јмғүм§Ҳмқҳ ліҖнҷ”к°Җ мӢӨм ң ALT м•”мқҳ л°ңмғқм—җлҸ„ мӨ‘мҡ”н•ң м—ӯн• мқ„ н• кІғмқҙлқјлҠ” мғҒкҙҖкҙҖкі„к°Җ кі„мҶҚ ліҙкі лҗҳкі мһҲлӢӨ. PanNETкіј GBM м•” нҷҳмһҗ мғҳн”Ңм—җм„ң мҲҳн–үлҗң мӢңнҖҖмӢұ кІ°кіјм—җ л”°лҘҙл©ҙ, ALT нҷңм„ұмқ„ лӮҳнғҖлӮҙлҠ” м•”м—җлҠ” ATRX нҳ№мқҖ DAXX мң м „мһҗмқҳ мІҙм„ёнҸ¬ лҸҢм—°ліҖмқҙ(somatic mutation)к°Җ лӮҳнғҖлӮҳлҠ” кІҪн–Ҙмқ„ ліҙмқёлӢӨ[30]. лүҙнҒҙл ҲмҳӨмўҖ лҰ¬лӘЁлҚёл§Ғм—җ кҙҖм—¬н•ҳлҠ” ATRX/DAXX лӢЁл°ұм§Ҳм—җ лҸҢм—°ліҖмқҙк°Җ мғқкё°л©ҙ лүҙнҒҙл ҲмҳӨмўҖмқҳ л°ҖлҸ„лҘј лӮ®м¶”кІҢ лҗңлӢӨ. лүҙнҒҙл ҲмҳӨмўҖ л°ҖлҸ„мқҳ к°җмҶҢлҠ” н…”лЎңлҜём–ҙ м „мӮ¬мІҙмқё TERRAмқҳ мҰқк°ҖлЎң мқҙм–ҙ진лӢӨ[31,32]. TERRAмқҳ кё°лҠҘмқҙ мҷ„м „нһҲ л°қнҳҖм§Җ진 м•Ҡм•ҳм§Җл§Ң мөңк·ј м—°кө¬кІ°кіјм—җ л”°лҘҙл©ҙ TERRAк°Җ н…”лЎңлҜём–ҙ DNAмҷҖ кІ°н•©н•ҳм—¬ R-loopмқҙлқјлҠ” RNA/DNA hybrid кө¬мЎ°лҘј нҳ•м„ұн•ҳкІҢ лҗҳлҠ”лҚ°, мқҙ кө¬мЎ°к°Җ RPA лӢЁл°ұм§Ҳкіј к°ҷмқҖ мғҒлҸҷ мһ¬мЎ°н•©м—җ кҙҖм—¬н•ҳлҠ” лӢЁл°ұм§Ҳмқ„ м„ёнҸ¬ мЈјкё° лҸҷм•Ҳ н…”лЎңлҜём–ҙ DNAм—җ лҚ” мҳӨлһ«лҸҷм•Ҳ кІ°н•©н•ҳлҸ„лЎқ н•ҳм—¬ мғҒлҸҷ мһ¬мЎ°н•©мқҙ мқјм–ҙлӮҳкё° мўӢмқҖ нҷҳкІҪмқ„ л§Ңл“ӨкІҢ лҗңлӢӨ[33,34].
л”°лқјм„ң, ALT м•”м„ёнҸ¬м—җм„ң мөңк·јк№Ңм§Җ мҲҳн–үлҗң м—°кө¬м—җ л”°лҘҙл©ҙ м•„м§Ғ лӘ…нҷ•нһҲ л°қнҳҖм§Җм§Җ м•ҠмқҖ кё°мһ‘м—җ мқҳн•ҙ ALT н…”лЎңлҜём–ҙмқҳ м„ңм—ҙ л°Ҹ м—јмғүм§Ҳ кө¬мЎ°к°Җ л°”лҖҢкІҢ лҗҳкі , к·ё кІ°кіј ALT н…”лЎңлҜём–ҙлҠ” мғҒлҸҷ мһ¬мЎ°н•©мқҙ мқјм–ҙлӮҳкё° мўӢмқҖ мғҒнғңлЎң л°”лҖҢм–ҙ н…”лЎңлЁёл ҲмқҙмҰҲ 비-мқҳмЎҙм Ғмқё л°©мӢқмңјлЎң н…”лЎңлҜём–ҙ кёёмқҙлҘј лҠҳлҰ¬кІҢ лҗңлӢӨ[35]. к·ёлҹ¬лӮҳ м•„м§Ғ лӘЁл“ ALT м•”м„ёнҸ¬к°Җ кіөмң н•ҳлҠ” мІҙм„ёнҸ¬ лҸҢм—°ліҖмқҙлӮҳ м„ёнҸ¬ лӮҙ ліҖнҷ”лҠ” л°ңкІ¬лҗҳм§Җ м•Ҡм•ҳлӢӨ. мқҙлҠ” ALTлқјлҠ” мқҙлҰ„мңјлЎң 묶여 мһҲлҠ” нҳ„мғҒ м•Ҳм—җ лӢӨм–‘н•ң кё°мһ‘мқҙ лӮҙмһ¬лҗҳм–ҙ мһҲмқҢмқ„ мӢңмӮ¬н•ңлӢӨ.
3. лӢӨм–‘н•ң мғқл¬јмқҳ лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘
лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘мқҖ м•”м„ёнҸ¬м—җм„ң мІҳмқҢ лӘ…лӘ…лҗҳм—Ҳкі , м•” м№ҳлЈҢмқҳ кҙҖм җм—җм„ң л§ҺмқҖ м—°кө¬к°Җ мҲҳн–үлҗҳм—Ҳкё° л•Ңл¬ём—җ мЈјлЎң ліёлһҳ кё°лҠҘмқҙ л§қк°Җм ё лӮҳнғҖлӮҳлҠ” лі‘лҰ¬м Ғ нҳ„мғҒмңјлЎң л°ӣм•„л“Өм—¬м ё мҷ”лӢӨ. к·ёлҹ¬лӮҳ м•һм„ң м–ёкёүн–ҲлҚҳ кІғмІҳлҹј ALTм—җлҠ” мҙҲнҢҢлҰ¬мҷҖ к°ҷмқҙ мһҗм—°м ҒмңјлЎң н…”лЎңлЁёл ҲмқҙмҰҲлҘј мһғм–ҙлІ„лҰ¬лҠ” мғҒнҷ©м—җм„ң к°ңмІҙ мғқмӢқм„ёнҸ¬мқҳ мҳҒмҶҚмқ„ лҸ•лҠ” м Ғмқ‘м Ғмқё мёЎл©ҙ лҳҗн•ң мЎҙмһ¬н•ңлӢӨ. к·ёлҹ¬лҜҖлЎң к°ңмІҙ мҲҳмӨҖм—җм„ң ALTмқҳ нҷңм„ұ л°Ҹ мЎ°м Ҳм—җ лҢҖн•ҙ мқҙн•ҙн•ҳлҠ” кІғмқҖ ALTмқҳ нҶөн•©м Ғ мқҙн•ҙлҘј мң„н•ҙ н•„мҲҳм ҒмқҙлӢӨ. л„җлҰ¬ м“°мқҙлҠ” лӘЁлҚё мғқл¬јмқё л‘җ мў…лҘҳмқҳ нҡЁлӘЁ(S. cerevisiae, S. pombe)мҷҖ мҳҲмҒңкј¬л§Ҳм„ м¶©(C. elegans)м—җм„ң н…”лЎңлЁёл ҲмқҙмҰҲк°Җ кІ°мҶҗлҗҳл©ҙ лі„лӢӨлҘё лҸҢм—°ліҖмқҙ м—ҶмқҙлҸ„ ALT нҷңм„ұмқҙ мјңм§Ҳ мҲҳ мһҲмқҢмқҙ ліҙкі лҗҳм—ҲлӢӨ(к·ёлҰј 4).
л‘җ мў…лҘҳмқҳ нҡЁлӘЁлҠ” 300 bp м •лҸ„мқҳ н…”лЎңлҜём–ҙ м„ңм—ҙмқ„ к°Җм§Җкі мһҲмңјл©°, мқёк°„кіј мң мӮ¬н•ҳкІҢ G м—јкё°к°Җ н’Қл¶Җн•ң нҳ•нғңмқҳ л°ҳліө м„ңм—ҙмқҙлӢӨ. нҡЁлӘЁмқҳ н…”лЎңлҜём–ҙ м„ңм—ҙлҸ„ л§Ҳм°¬к°Җм§ҖлЎң н…”лЎңлҜём–ҙ кІ°н•© лӢЁл°ұм§Ҳмқҙ лҒқл¶Җ분мқ„ DNA мҶҗмғҒ мӢ нҳёлЎңл¶Җн„° ліҙнҳён•ңлӢӨ. н…”лЎңлЁёл ҲмқҙмҰҲ мң м „мһҗк°Җ кІ°мҶҗлҗң кІҪмҡ°м—җлҠ” л§Ө м„ёлҢҖ 5 bp к°Җлҹүм”© н…”лЎңлҜём–ҙк°Җ к°җмҶҢн•ҳкі , м—ӯм№ҳк°’м—җ лҸ„лӢ¬н•ҳл©ҙ м„ёнҸ¬ 분м—ҙмқҙ л©Ҳ추кІҢ лҗңлӢӨ. л‘җ мў…лҘҳмқҳ нҡЁлӘЁ лӘЁл‘җ н…”лЎңлҜём–ҙлЎң мқён•ң м„ёнҸ¬ л…ёнҷ”лҘј к·№ліөн•ҳкі , лӢӨмӢң 분м—ҙмқ„ мӢңмһ‘н•ҳлҠ” мғқмЎҙ к°ңмІҙк°Җ мғқкІЁлӮңлӢӨ. мқҙ к°ңмІҙлҠ” ALTлҘј нҶөн•ҙ н…”лЎңлҜём–ҙ кёёмқҙлҘј лҠҳлҰ¬кІҢ лҗҳлҠ”лҚ°, л‘җ мў…лҘҳмқҳ нҡЁлӘЁм—җм„ң к°Ғк°Ғ л‘җ к°Җм§Җ л°©мӢқмқҳ ALT кё°мһ‘мқҙ лӮҳнғҖлӮңлӢӨ[36,37].
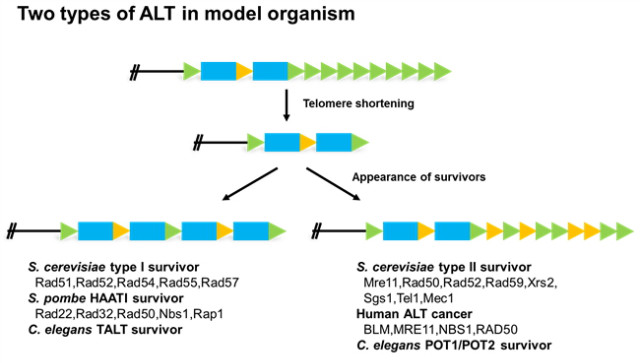 к·ёлҰј 4. лӢӨм–‘н•ң лӘЁлҚёлҸҷл¬јмқҳ ALT нҷңм„ұ
S. cerevisiae м—җм„ң лӮҳнғҖлӮҳлҠ” л‘җ к°Җм§Җ л°©мӢқмқҳ ALTлҠ” type I, type II мғқмЎҙмһҗ(survivor)лқј л¶ҲлҰ°лӢӨ. л‘җ мў…лҘҳмқҳ мғқмЎҙмһҗлҠ” ALT нҷңм„ұм—җ кҙҖм—¬н•ҳлҠ” мң м „мһҗмқҳ мў…лҘҳк°Җ лӢӨлҘҙл©°, ALT нҷңм„ұ мқҙнӣ„ нҳ•м„ұлҗң н…”лЎңлҜём–ҙмқҳ нҳ•нғң м—ӯмӢң лӢӨлҘҙлӢӨ. Type I мғқмЎҙмһҗмқҳ кІҪмҡ° н…”лЎңлҜём–ҙ мқём ‘ м„ңм—ҙмқё м„ңлёҢ-н…”лЎңлҜём–ҙм—җ мң„м№ҳн•ң YвҖІ elementлҘј мқҙмҡ©н•ҳм—¬ ALT н…”лЎңлҜём–ҙлҘј кө¬м„ұн•ңлӢӨ. мҰү, ліёлһҳ н…”лЎңлҜём–ҙ м„ңм—ҙмқҙ YвҖҷ elementлЎң лҢҖмІҙлҗҳкІҢ лҗңлӢӨ. Type I ALTмқҳ мһ‘лҸҷм—җлҠ” мғҒлҸҷ мһ¬мЎ°н•©м—җ кҙҖм—¬н•ҳлҠ” Rad51, Rad52, Rad54, Rad57к°Җ н•„мҡ”н•ҳлӢӨ. Type II мғқмЎҙмһҗмқҳ кІҪмҡ°м—җлҠ” н…”лЎңлҜём–ҙ к°„мқҳ мғҒлҸҷ мһ¬мЎ°н•©мқ„ нҶөн•ҙ н…”лЎңлҜём–ҙ кёёмқҙлҘј лҠҳлҰ°лӢӨ. л°ҳліө м„ңм—ҙ лӮҙм—җм„ң мһ¬мЎ°н•©мқҙ мқјм–ҙлӮ л•Ң нқ”нһҲ л°ңмғқн•ҳлҠ” лҸҷмқјн•ҳм§Җ м•ҠмқҖ көҗм°Ё(unequal crossover)мқҳ кІ°кіј ліёлһҳ н…”лЎңлҜём–ҙліҙлӢӨ кёёмқҙк°Җ кёҙ н…”лЎңлҜём–ҙл¶Җн„° 짧мқҖ н…”лЎңлҜём–ҙк№Ңм§Җ лӢӨм–‘н•ң кёёмқҙмқҳ н…”лЎңлҜём–ҙк°Җ лӮҳнғҖлӮҳкІҢ лҗңлӢӨ. Type II ALTмқҳ мһ‘лҸҷм—җлҸ„ л§Ҳм°¬к°Җм§ҖлЎң мғҒлҸҷ мһ¬мЎ°н•©мқ„ мЎ°м Ҳн•ҳлҠ” мң м „мһҗк°Җ кҙҖм—¬н•ҳлҠ”лҚ°, Type Iмқ„ мЎ°м Ҳн•ҳлҠ” мЎ°н•©кіјлҠ” м•Ҫк°„ лӢӨлҘё Rad50, Rad52, Rad59, MRN complex л“ұмқҙ н•„мҡ”н•ҳлӢӨ[38].
S. pombeлҠ” мӣҗнҳ• м—јмғүмІҙк°Җ лҗҳм–ҙлҸ„ мғқмЎҙм—җ л¬ём ңк°Җ м—ҶмңјлҜҖлЎң, н…”лЎңлЁёл ҲмқҙмҰҲк°Җ кІ°мҶҗлҗң кІҪмҡ° мӣҗнҳ• м—јмғүмІҙк°Җ лҗҳлҠ” кІҪмҡ°лҸ„ мЎҙмһ¬н•ңлӢӨ. мӣҗнҳ• м—јмғүмІҙк°Җ лҗҳм§Җ м•ҠлҠ” кІҪмҡ°м—җ м„ нҳ• м—јмғүмІҙлҘј к°Җ진 л‘җ к°Җм§Җ мў…лҘҳмқҳ ALT мғқмЎҙмһҗк°Җ нғ„мғқн•ңлӢӨ. мІ« лІҲм§ё мў…лҘҳлҠ” S. cerevisiae мқҳ Type II мғқмЎҙмһҗмҷҖ мң мӮ¬н•ң нҳ•нғңлЎң н…”лЎңлҜём–ҙ к°„мқҳ мғҒлҸҷ мһ¬мЎ°н•©мңјлЎң н…”лЎңлҜём–ҙ кёёмқҙлҘј лҠҳлҰ°лӢӨ. S. cerevisiaeмҷҖ мң мӮ¬н•ҳкІҢ Rad52, MRN complexк°Җ н•„мҡ”н•ҳлӢӨлҠ” кІғмқҙ л°қнҳҖмЎҢм§Җл§Ң, м•„м§Ғ л§ҺмқҖ м—°кө¬к°Җ мҲҳн–үлҗҳм§Җ м•Ҡм•ҳлӢӨ. S. pombeмқҳ л‘җ лІҲм§ё ALT мғқмЎҙмһҗлҠ” HAATI (Heterochromatin Amplification dependent And Telomerase Independent)лқјкі л¶ҲлҰ°лӢӨ. мқҙлҰ„м—җм„ң м¶”м •н• мҲҳ мһҲл“Ҝмқҙ HAATI мғқмЎҙмһҗлҠ” мқҙм§Ҳ м—јмғүм§Ҳмқ„ мЈјнҳ•мңјлЎң н…”лЎңлҜём–ҙ кёёмқҙлҘј лҠҳлҰ¬л©°, лҢҖн‘ңм Ғмқё мқҙм§Ҳ м—јмғүм§Ҳмқё rDNAмҷҖ м„ңлёҢ-н…”лЎңлҜём–ҙ л¶Җмң„лҘј мқҙмҡ©н•ңлӢӨ. ліөм ңлҗң rDNA м„ңм—ҙмқҖ нһҲмҠӨнҶӨ м•„м„ёнӢёкё°лҘј м ңкұ°н•ҳлҠ” HDACкіј н…”лЎңлҜём–ҙ лӢЁмқј к°ҖлӢҘ кІ°н•© лӢЁл°ұм§Ҳмқё Pot1м—җ кІ°н•©н•ҳлҠ” лӢЁл°ұм§Ҳмқё Ccq1мқ„ л¶Ҳлҹ¬л“Өм—¬ мғҲлЎӯкІҢ л§Ңл“Өм–ҙ진 н…”лЎңлҜём–ҙ м„ңм—ҙмқ„ ліҙнҳён•ңлӢӨ[39].
HAATI мғқмЎҙмһҗмқҳ н…”лЎңлҜём–ҙк°Җ н…”лЎңлҜём–ҙ мқём ‘ м„ңм—ҙлЎң лҢҖмІҙлҗңлӢӨлҠ” м җм—җм„ң S. cerevisiae мқҳ Type I мғқмЎҙмһҗмҷҖ мң мӮ¬н•ҳлӢӨ. лҳҗн•ң н…”лЎңлҜём–ҙмқҳ нҠ№м • л°ҳліө м„ңм—ҙмқ„ мқём§Җн•ҳкі кІ°н•©н•ҳлҠ” лӢЁл°ұм§Ҳмқҳ ліҙнҳё кё°мһ‘мқҙ мӨ‘мҡ”н•ң н…”лЎңлЁёл ҲмқҙмҰҲ мқҳмЎҙм Ғмқё мң м§Җкё°мһ‘кіјлҠ” лӢ¬лҰ¬, н…”лЎңлҜём–ҙ м„ңм—ҙм—җ нҠ№мқҙм Ғмқҙм§Җ м•ҠмқҖ мқҙм§Ҳ м—јмғүм§Ҳ кІ°н•© лӢЁл°ұм§Ҳмқҙ мӨ‘мҡ”н•ҳлӢӨлҠ” м җмқҖ мҙҲнҢҢлҰ¬мҷҖ мң мӮ¬н•ҳлӢӨ. мҙҲнҢҢлҰ¬мқҳ кІҪмҡ° HTT element (HeT-A, TART, TAHRE м„ё мў…лҘҳмқҳ л ҲнҠёлЎңнҠёл ҢмҠӨнҸ¬мЎҙмңјлЎң кө¬м„ұ)лЎң н…”лЎңлҜём–ҙк°Җ кө¬м„ұлҗҳм–ҙ мһҲлҠ”лҚ°, HTT element м—јкё°м„ңм—ҙм—җ 비-нҠ№мқҙм ҒмңјлЎң кІ°н•©н•ҳлҠ” мқҙм§Ҳ м—јмғүм§Ҳ лӢЁл°ұм§Ҳмқё HP1кіј HP1 кІ°н•© лӢЁл°ұм§Ҳ(HOAP, HipHop, moi)м—җ мқҳн•ҙ н…”лЎңлҜём–ҙк°Җ ліҙнҳёлҗңлӢӨ. лӢӨм–‘н•ң мқҙм§Ҳ м—јмғүм§Ҳ м§Җм—ӯ мӨ‘м—җ мҷң rDNA нҳ№мқҖ м„ңлёҢ-н…”лЎңлҜём–ҙ л¶Җмң„к°Җ м„ нғқлҗҳм–ҙ ліөм ңлҗҳлҠ”м§Җ кё°мһ‘мқҙ м•„м§Ғ л°қнҳҖм§Җ진 м•Ҡм•ҳм§Җл§Ң, ліөм ңлҗң м„ңм—ҙмқҙ мқҙм§Ҳ м—јмғүм§Ҳмқ„ нҳ•м„ұн•ҳм—¬ DNA мҶҗмғҒ мӢ нҳёлҘј м–өм ңн•ҳлҠ” кё°мһ‘мқҙ ALT н…”лЎңлҜём–ҙмқҳ нҷ•лҰҪ л°Ҹ мң м§Җм—җ мӨ‘мҡ”н•Ёмқ„ м•Ң мҲҳ мһҲлӢӨ[40].
мҙҲнҢҢлҰ¬мқҳ 진нҷ” кіјм •м—җм„ң ALTлЎң н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘мқҳ м „нҷҳмқҙ мқјм–ҙлӮң кІғмІҳлҹј лӢӨм„ёнҸ¬ мғқл¬јмқё мҳҲмҒңкј¬л§Ҳм„ м¶©м—җм„ңлҸ„ мқҙлҹ¬н•ң м „нҷҳмқҙ мң лҸ„лҗ мҲҳ мһҲлӢӨ. мҳҲмҒңкј¬л§Ҳм„ м¶©мқҳ н…”лЎңлҜём–ҙлҠ” мқёк°„кіј мң мӮ¬н•ң 8 kb к°Җлҹүмқҳ TTAGGCмқҳ л°ҳліө м„ңм—ҙлЎң кө¬м„ұлҗҳм–ҙ мһҲкі , н…”лЎңлЁёл ҲмқҙмҰҲк°Җ кІ°мҶҗлҗң кІҪмҡ° л§Ө м„ёлҢҖ 150 bp к°Җлҹүм”© н…”лЎңлҜём–ҙк°Җ к°җмҶҢн•ңлӢӨ. л‘җ мў…лҘҳмқҳ нҡЁлӘЁмІҳлҹј мҳҲмҒңкј¬л§Ҳм„ м¶©м—җм„ңлҸ„ л‘җ к°Җм§Җ л°©мӢқмқҳ ALTк°Җ лӮҳнғҖлӮңлӢӨ. мІ« лІҲм§ё л°©мӢқмқҖ н…”лЎңлҜём–ҙ к°„мқҳ мғҒлҸҷ мһ¬мЎ°н•©мңјлЎң н…”лЎңлҜём–ҙ кёёмқҙлҘј лҠҳлҰ°лӢӨ. мқҙлҹ¬н•ң л°©мӢқмқҳ ALTк°Җ нҷңм„ұнҷ”лҗҳл Өл©ҙ л§ҺмқҖ к°ңмІҙ мҲҳк°Җ н•„мҡ”н•ңлҚ°, лӢЁмқјк°ҖлӢҘ н…”лЎңлҜём–ҙ кІ°н•© лӢЁл°ұм§Ҳмқё POT-1мқҙлӮҳ POT-2к°Җ кІ°мҶҗлҗң кІҪмҡ°м—җ ALT мғқмЎҙмһҗмқҳ л°ңмғқ нҷ•лҘ мқҙ лҶ’아진лӢӨ[41,42]. л‘җ лІҲм§ё л°©мӢқмқҖ м„ңлёҢ-н…”лЎңлҜём–ҙ л¶Җмң„м—җ мң„м№ҳн•ң TALT (template for ALT)лҘј мЈјнҳ•мңјлЎң н•ҳм—¬ ALT н…”лЎңлҜём–ҙлҘј кө¬м„ұн•ҳлҠ” л°©мӢқмқҙлӢӨ[43]. мқҙ л°©мӢқмқҖ кё°мЎҙ н…”лЎңлҜём–ҙлҘј мғҲлЎңмҡҙ м„ңм—ҙлЎң лҢҖмІҙн•ңлӢӨлҠ” м җм—җм„ң Type I мғқмЎҙмһҗ, HAATI, мҙҲнҢҢлҰ¬мҷҖ мң мӮ¬н•ң л°©мӢқмқҙлӢӨ. лӢӨлҘё мў…мқҳ кІҪмҡ°мІҳлҹј TALTлҸ„ мқҙм§Ҳ м—јмғүм§Ҳмқ„ нҳ•м„ұн•ҳлҠ”м§Җ м•„лӢҲл©ҙ нҠ№м •н•ң мғҒлҸҷ мһ¬мЎ°н•© кё°мһ‘мқҙ н•„мҡ”н•ңм§ҖлҠ” м•„м§Ғ л°қнҳҖм§Җм§Җ м•Ҡм•ҳлӢӨ.
4. мҙҲкё° 진нҷ” лӢ№мӢң н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘ л°Ҹ кІ°лЎ
н…”лЎңлЁёл ҲмқҙмҰҲк°Җ 진н•өмғқл¬јм—җ л„җлҰ¬ нҚјм ёмһҲлҠ” кІғмңјлЎң ліҙм•„ м„ нҳ• м—јмғүмІҙ 진нҷ” мҙҲкё°м—җ лӮҳнғҖлӮ¬мқ„ кІғмңјлЎң ліҙмқҙм§Җл§Ң, н…”лЎңлЁёл ҲмқҙмҰҲмҷҖ м„ нҳ•м—јмғүмІҙмқҳ л“ұмһҘмқҙ лҸҷмӢңм—җ мқјм–ҙлӮ¬мқ„ кІғмқҙлқјкі мҳҲмғҒн•ҳкёҙ м–ҙл өлӢӨ[44]. н…”лЎңлЁёл ҲмқҙмҰҲк°Җ лӮҳнғҖлӮҳкё° м „м—җ м„ нҳ•м—јмғүмІҙк°Җ л“ұмһҘн–ҲлӢӨл©ҙ мӣҗн•өмғқл¬јм—җ мқҙлҜё мЎҙмһ¬н–ҲлҚҳ нҠ№м • кё°мһ‘мқ„ мӮ¬мҡ©н•ҳм—¬ лҒқл¶Җ분мқ„ ліҙнҳён•ҳл Өкі мӢңлҸ„н–Ҳмқ„ кІғмқҙлӢӨ. мӢӨм ңлЎң мӣҗн•өмғқл¬јмқҳ лҜёнҶ мҪҳл“ңлҰ¬м•„лӮҳ л°”мқҙлҹ¬мҠӨ л“ұм—җм„ң мў…мў… м„ нҳ•м—јмғүмІҙк°Җ лӮҳнғҖлӮҳл©°, к·ё м„ нҳ•м—јмғүмІҙлҘј ліҙнҳён•ҳкё° мң„н•ҙ мғҒлҸҷ мһ¬мЎ°н•©, л ҲнҠёлЎңнҠёлһңмҠӨнҸ¬м§Җм…ҳ(retrotranspoistion) л“ұмқҳ л°©лІ•мңјлЎң лҒқл¶Җ분мқ„ ліҙнҳён•ңлӢӨ[45-47]. 진нҷ” кіјм •м—җм„ң лӢӨм–‘н•ң л ҲнҠёлЎңнҠёлһңмҠӨнҸ¬мЎҙ к°ҖмҡҙлҚ° лҒқл¶Җ분мқ„ м•Ҳм •м ҒмңјлЎң ліҙнҳён•ҳлҠ” н…”лЎңлЁёл ҲмқҙмҰҲк°Җ л“ұмһҘн•ҳмҳҖмқ„ кІғмқҙкі , мһҗм—°м„ нғқм—җм„ң мҡ°мң„лҘј к°Җм§ҖкІҢ лҗҳм—Ҳмқ„ кІғмқҙлӢӨ.
ліё лҸҷн–ҘлҰ¬нҸ¬нҠём—җм„ң мӮҙнҺҙліё ALTлҠ” мӣҗн•өмғқл¬ј л•Ңл¶Җн„° мЎҙмһ¬н–ҲлҚҳ мҳӨлһҳлҗң м„ нҳ•м—јмғүмІҙ ліҙнҳё кё°мһ‘кіј мң мӮ¬н•ҳлӢӨ. н…”лЎңлЁёл ҲмқҙмҰҲк°Җ 진нҷ”н•ң нӣ„ ALTлҠ” н…”лЎңлЁёл ҲмқҙмҰҲм—җ к·ё мһҗлҰ¬лҘј лӮҙмЈјм—Ҳмқ„ кІғмқҙлӢӨ. к·ёлҹ¬лӮҳ ALTлҠ” м—¬м „нһҲ н…”лЎңлҜём–ҙм—җ мң„кё°к°Җ л°ңмғқн•ҳл©ҙ к·ё мһҗлҰ¬лҘј ліҙнҳён•ҳкё° мң„н•ң вҖҳл°ұм—…вҖҷ кё°мһ‘мңјлЎң м„ёнҸ¬ лӮҙм—җ лЁёл¬јкі мһҲлӢӨ. мӢӨм ңлЎң н…”лЎңлҜём–ҙ кё°лҠҘмқҙ л§қк°Җ진 S. cerevisiaeм—җм„ң л ҲнҠёлЎңнҠёлһңмҠӨнҸ¬мЎҙмқҙ н…”лЎңлҜём–ҙлЎң мҳ®кІЁк°ҖлҠ” нҳ„мғҒмқҙ ліҙкі лҗҳм—Ҳмңјл©°, CHO (Chinese hamster ovary) м„ёнҸ¬м—җм„ңлҸ„ LINE-1 л ҲнҠёлЎңнҠёлһңмҠӨнҸ¬мЎҙмқҙ н…”лЎңлҜём–ҙлЎң мҳ®кІЁк°ҖлҠ” нҳ„мғҒмқҙ ліҙкі лҗҳм—ҲлӢӨ[48,49]. лҳҗн•ң мқёк°„ н—ӨлҘҙнҺҳмҠӨ л°”мқҙлҹ¬мҠӨмқё HHV-6A, HHV-6Bк°Җ мқёк°„ м„ёнҸ¬м—җ к°җм—јлҗ л•Ң, н…”лЎңлҜём–ҙ л¶Җмң„лЎң лҒјм–ҙ л“Өм–ҙк°ҖлҠ” нҳ„мғҒмқҖ н…”лЎңлҜём–ҙк°Җ л ҲнҠёлЎңнҠёлһңмҠӨнҸ¬мЎҙмқ„ нҸ¬н•Ён•ң м„ңм—ҙмқҙ лҒјм–ҙ л“Өм–ҙк°Җм§Җ мўӢмқҖ кө¬мЎ°мһ„мқ„ мӢңмӮ¬н•ңлӢӨ[50]. мқҙлҹ¬н•ң нҳ„мғҒмқ„ нҸ¬н•Ён•ҳм—¬ м•һм„ң мӮҙнҺҙліё лӘЁлҚёмғқл¬јм—җм„ң н…”лЎңлЁёл ҲмқҙмҰҲк°Җ кІ°мҶҗлҗң нӣ„ ALTк°Җ нҷңм„ұнҷ”лҗҳлҠ” кё°мһ‘мқҖ мҙҲнҢҢлҰ¬, м–‘нҢҢ л“ұмқҳ н…”лЎңлҜём–ҙ 진нҷ” кіјм •м—җ кҙҖм—¬н–Ҳмқ„ кІғмңјлЎң мҳҲмғҒн•ңлӢӨ.
к·ёлҹ°лҚ° ALTк°Җ лӢЁмҲңнһҲ л°ұм—… кё°мһ‘мңјлЎңл§Ң лЁёл¬јкі мһҲмқ„к№Ң? м•„м§Ғ л§ҺмқҖ м—°кө¬ кІ°кіјк°Җ лӮҳмҳӨ진 м•Ҡм•ҳм§Җл§Ң, л°°м•„ л°ңмғқкіјм •м—җм„ң ALTк°Җ мӨ‘мҡ”н•ң м—ӯн• мқ„ н• кІғмқҙлқјлҠ” лӘҮ к°Җм§Җ ліҙкі к°Җ мһҲлӢӨ. мҘҗмқҳ л°°м•„ л°ңмғқкіјм •м—җм„ң 2-м„ёнҸ¬кё°м—җм„ң н…”лЎңлҜём–ҙ кёёмқҙк°Җ кёүкІ©н•ҳкІҢ мҰқк°Җн•ҳлҠ”лҚ°, мқҙ кіјм •мқҙ мғҒлҸҷ мһ¬мЎ°н•© мқҳмЎҙм Ғмқё л°©мӢқмңјлЎң мқјм–ҙлӮңлӢӨ[51,52]. к·ёл ҮлӢӨл©ҙ л°ңмғқ мӢңкё°м—җ н…”лЎңлҜём–ҙ кёёмқҙлҘј мЎ°м Ҳн•ҳлҚҳ ALTк°Җ н…”лЎңлЁёл ҲмқҙмҰҲ кІ°мҶҗмқҙ л°ңмғқн•ҳмҳҖмқ„ л•Ң, к·ё мң„кё°лҘј к·№ліөн•ҳкё° мң„н•ҙ нҷңм„ұнҷ”лҗҳлҠ” кІғмқјм§ҖлҸ„ лӘЁлҘёлӢӨ. к·ёлҹ¬лӮҳ л°ңмғқ мӢңкё°мқҳ мғҒлҸҷ мһ¬мЎ°н•© мқҳмЎҙм Ғмқё н…”лЎңлҜём–ҙ мЎ°м Ҳ кё°мһ‘мқҙ ALTмҷҖ к°ҷмқҖ л°©мӢқмңјлЎң мһ‘лҸҷн•ҳлҠ” кІғмқём§ҖлҠ” м•„м§Ғ л°қнҳҖм§Җм§Җ м•Ҡм•ҳлӢӨ. ALT кё°мһ‘мқҙ м–ҙл–»кІҢ мӢңмһ‘лҗҳлҠ”м§Җ, к·ёлҰ¬кі мӢңмһ‘лҗң ALT кё°мһ‘мқҖ м–ҙл– н•ң л°©мӢқмңјлЎң мң м§ҖлҗҳлҠ”м§Җ л°қнҳҖ진лӢӨл©ҙ м„ нҳ• м—јмғүмІҙ 진нҷ”мқҳ мӨ‘мҡ”н•ң кі лҰ¬ мӨ‘ н•ҳлӮҳлҘј мқҙн•ҙн•ҳлҠ”лҚ° кё°м—¬н• кІғмқҙлӢӨ.
м¶ңмІҳ : мғқл¬јн•ҷм—°кө¬м •ліҙм„јн„°(BRIC) (л°”лЎңк°Җкё°) |
IP : 192.168.31.*** 
![[BRIC] лҢҖм•Ҳм Ғ н…”лЎңлҜём–ҙ мң м§Җкё°мһ‘мқҳ 진нҷ”м Ғ мқҳмқҳмҷҖ м—°кө¬лҸҷн–Ҙ кІҢмӢңл¬јлЎң л°”лЎңк°Җкё°,QRмҪ”л“ң https://yesme.kiom.re.kr/Trend/articles/view/tableid/tech/id/1333](/attach/qrcode/board_1333.png)
|
| лІҲнҳё | нҢҢмқј | м ңлӘ© | мқҙлҰ„ | мһ‘м„ұмқј | мЎ°нҡҢмҲҳ |
|---|---|---|---|---|---|
| 455 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2020.01.02 | 12,457 | ||
| 454 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.10.14 | 27,596 | ||
| 453 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.28 | 13,625 | ||
| 452 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.28 | 11,776 | ||
| 451 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.08 | 13,081 | ||
| 450 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.08 | 13,653 | ||
| 449 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.08.08 | 12,532 | ||
| 448 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.07.25 | 13,039 | ||
| 447 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.07.25 | 13,271 | ||
| 446 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.07.25 | 11,950 | ||
| 445 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.06.03 | 16,051 | ||
| 444 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.05.29 | 17,076 | ||
| 443 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.05.22 | 16,541 | ||
| 442 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.05.22 | 16,236 | ||
| 441 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.04.01 | 16,690 | ||
| 440 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2019.04.01 | 17,691 | ||
| 439 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.23 | 29,641 | ||
| 438 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.23 | 18,234 | ||
| 437 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.21 | 21,575 | ||
| 436 | кё°мҲ мӮ¬м—…нҷ”нҢҖ | 2018.05.09 | 17,151 | ||